
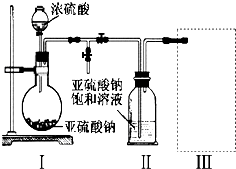


分析 (1)装置I中浓硫酸与亚硫酸钠反应产生二氧化硫气体,同时生成硫酸钠和水;该反应是离子反应,实质是2H++SO32--=H2O+SO2.硫酸过浓,H+浓度小,不利反应进行;硫酸浓度过小,水就多,生成的SO2易溶于水;
(2)装置Ⅱ中析出Na2S2O5晶体,通过过滤操作得到该晶体;
(3)处理过量的SO2尾气,既要吸收SO2尾气,同时能防倒吸;
(4)①铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;
②鉴别SO2和CO2气体是利用二氧化硫和二氧化碳性质和反应现象的不同区别;
③依据化学方程式定量关系计算,反应生成的二氧化硫物质的量=$\frac{22.4yL}{22.4L/mol}$=ymol,生成的硫酸铜物质的量=xmol-ymol,加入铁会和硫酸铜发生置换反应生成铜,生成铜物质的量等于反应铁的物质的量等于硫酸铜的物质的量;
(5)①根据反应“SO2+I2+2H2O=H2SO4+2HI”,则样品中抗氧化剂的残留量=$\frac{0.01mol/L×0.025L×64g/mol}{0.1000L}$=0.16 g/L;
②若有部分HI被空气氧化又生成I2,导致消耗标准I2溶液的体积偏小,则测得结果偏低;
解答 解:(1)装置I中浓硫酸与亚硫酸钠反应产生二氧化硫气体,同时生成硫酸钠和水,化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O,该反应是离子反应,实质是2H++SO32--=H2O+SO2.硫酸过浓,H+浓度小,不利反应进行;硫酸浓度过小,水就多,生成的SO2易溶于水,一般情况采用70%的H2SO4
,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O,该反应是离子反应,实质是2H++SO32--=H2O+SO2.硫酸过浓,H+浓度小,不利反应进行;硫酸浓度过小,水就多,生成的SO2易溶于水,一般情况采用70%的H2SO4;
(2)装置Ⅱ中析出Na2S2O5晶体,通过过滤操作得到该晶体;
故答案为:过滤;
(3)处理过量的SO2尾气,a项装置瓶口封闭,错误;b项食盐水不能将大量的SO2尾气吸收,错误;c项漏斗口没入了液体中,错误,d项氢氧化钠溶液可吸收SO2尾气,同时能防倒吸,正确;
故答案为:d;
(4)①铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②鉴别SO2和CO2气体需要依据二者性质的不同分析,
a.酸化的Ca(NO3)2溶液中通入二氧化硫会发生氧化还原反应生成气体和微溶物硫酸钙,二氧化碳通入不反应,可以鉴别二氧化碳和二氧化硫,故a不符合;
b.二氧化碳和二氧化硫通入澄清石灰水都发生反应分别生成碳酸钙、亚硫酸钙白色沉淀,不能鉴别二氧化碳和二氧化硫,故b符合;
c.FeCl3和BaCl2混合溶液中通入二氧化硫会被氯化铁氧化为硫酸,结合钡离子生成白色沉淀,二氧化碳不反应,故c不符合;
d.亚硫酸、碳酸酸性大于硅酸,二氧化碳和二氧化硫通入Na2SiO3溶液都会反应生成硅酸沉淀,不能鉴别二氧化碳和二氧化硫,故d符合;
e.二氧化硫通入溴水会褪色,二氧化碳不反应,能鉴别二氧化碳和二氧化硫,故e不符合;
f.二氧化碳、二氧化硫通入CaCl2溶液都不发生反应,不能鉴别二氧化碳和二氧化硫,故f符合;
故选bdf;
故答案为:bdf;
③反应生成的二氧化硫物质的量=$\frac{22.4yL}{22.4L/mol}$=ymol,Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,依据硫元素守恒得到生成的硫酸铜物质的量=xmol-ymol,加入铁会和硫酸铜发生置换反应生成铜,Fe+CuSO4=Cu+FeSO4,生成铜物质的量等于反应铁的物质的量等于硫酸铜的物质的量,反应的铁物质的量为(x-y)mol,质量=56g/mol×(x-y)mol=56(x-y)g,
故答案为:56(x-y);
(5)①根据反应“SO2+I2+2H2O=H2SO4+2HI”,则样品中抗氧化剂的残留量=$\frac{0.01mol/L×0.025L×64g/mol}{0.1000L}$=0.16 g/L;
故答案为:0.16;
②若有部分HI被空气氧化又生成I2,导致消耗标准I2溶液的体积偏小,则测得结果偏低;
故答案为:偏低.
点评 本题考查SO2的制取,Na2S2O5含量的测定,实验操作等基础知识,化学方程式计算,物质检验方法分析判断,难度中等,掌握实验原理是解题的关键.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题

| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100mL溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色固体 | 1.248 | 133 | 300 | 0.04 | 24 | 溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 点a处的正反应速率比点b处的大 | |
| B. | 点c处的正反应速率与逆反应速率相等 | |
| C. | 点d(t1时刻)的n(N2)比点e(t2时刻)处的n(N2)大 | |
| D. | 其他条件不变,773K下反应至t1时刻,此时画出的两根平行线间的距离将要变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题



| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇,乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇,笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇,乙醚等有机溶剂 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com