
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
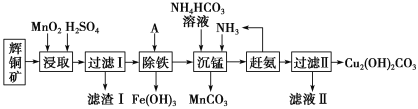
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有____(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:____。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为____mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____。
(5)“赶氨”时,最适宜的操作方法是____。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
(7)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是____。
【答案】充分搅拌,适当增加硫酸浓度,加热等符合题意的任一答案均可 2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O 3.7~5.6( 或3.7≤pH<5.6) 4.0×10-11 Mn2++HCO3-+NH3=MnCO3↓+NH4+ 将溶液加热 (NH4)2SO4 取少量最后一次洗涤液于洁净的试管中,加入足量稀盐酸酸化,再加入BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净,反之未洗净。(其它合理答案也可)
【解析】
辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液PH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜。
(1)加快“浸取”速率,即为加快酸浸反应速率,除将辉铜矿粉碎外,还可采取的措施有充分搅拌,适当增加硫酸浓度,加热等符合题意的任一答案均可,
答案为:充分搅拌,适当增加硫酸浓度,加热等符合题意的任一答案均可;
(2)由分析中滤渣1的成分可知,反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,
答案为:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;
(3)根据表格数据铁离子完全沉淀时的pH为3.7,但不能沉淀其他金属离子,故结合各金属离子沉淀时的pH值可知,溶液的pH不能高于5.6,则调节pH调的范围为3.7~5.6( 或3.7≤pH<5.6);当溶液pH调为5时,c(H+)=10-5mol/L,c(OH-)= =10-9 mol/L,已知Ksp[Fe(OH)3]=4.0×10-38,则c(Fe3+)=
=10-9 mol/L,已知Ksp[Fe(OH)3]=4.0×10-38,则c(Fe3+)= =
= =4.0×10-11 mol/L,
=4.0×10-11 mol/L,
答案为:3.7~5.6( 或3.7≤pH<5.6);4.0×10-11;
(4)“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,反应的离子方程式为Mn2++HCO3-+NH3=MnCO3↓+NH4+,
故答案为:Mn2++HCO3-+NH3=MnCO3↓+NH4+;
(5)“赶氨”时,最适宜的操作方法是减小氨气溶解度,氨气是易挥发的气体,加热驱赶,
故答案为:将溶液加热;
(6)滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体,
故答案为:(NH4)2SO4;
(7)检验沉淀是都洗净,主要是检验沉淀表面是否含有硫酸根离子,则操作为取少量最后一次洗涤液于洁净的试管中,加入足量稀盐酸酸化,再加入BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净,反之未洗净,
答案为:取少量最后一次洗涤液于洁净的试管中,加入足量稀盐酸酸化,再加入BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净,反之未洗净。


科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均釆用虚线表示。

(1)写出基态Cu原子的核外电子排布式____,S原子的价层电子排布图______
(2)写出胆矾晶体中水合铜离子的结构简式_____(必须将配位键表示出来)。
(3)向CuSO4溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式_____。比较NH3和[Cu(NH3)4]2+中H-N-H 中键角的大小:NH3_____[Cu(NH3)4]2+(填“![]() ” “
” “![]() ” 或“=”)。
” 或“=”)。
(4)已知H2O2的结构如图:

H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,估计它难溶于CS2,简要说明原因______。
(5)分析下表中两种物质的键能数据(单位:kJ/mol)。
A—B | A=B |
| |
CO | 357.7 | 798.9 | 1 071.9 |
N2 | 154.8 | 418.4 | 941.7 |
结合数据说明CO比N2活泼的原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有丰富的矿产、能源、药物、水产等化学化工资源,下图是某工厂对海水资源综合利用的示意图。下列有关说法正确的是 ( )
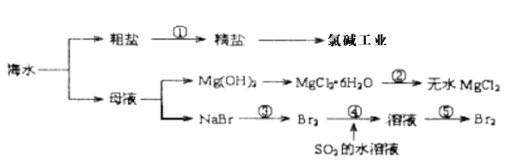
A.海水中含有丰富的Mg元素,利用母液沉淀Mg2+时,使用是石灰乳作为沉淀剂
B.流程②为:将MgCl2·6H2O在空气中受热分解即可制的无水MgCl2
C.在流程③④⑤中溴元素均被氧化
D.流程①中欲除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,操作步骤为:依次加入BaCl2溶液、NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计城市机动车辆每年以15%至20%的速度增长,交通事故也频发,汽车在剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。则下列判断正确的是
A. 还原剂与氧化产物的物质的量之比为5:8
B. 若氧化产物比还原产物多1.4mol则转移电子为1mol
C. 每生成1.6mol氮气,则有0.2molKNO3被氧化
D. NaN3是只含有离子键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫草宁(shikonin,见下图)是从生长在亚洲学名叫Lithospermum erythrorhizon的一种植物的根部提取出来的红色化合物。几个世纪以来用做民间药物,如今用于配制治疗跌打损伤的膏药。下列说法不正确的是( )

A. 紫草宁的分子式为C16H16O5
B. 等量的紫草宁与NaOH溶液、浓溴水反应,消耗NaOH、Br2 的物质的量之比为3:4
C. 紫草宁既能发生氧化反应又能发生还原反应
D. 常温下紫草宁不易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期X、Y、Z、W四种元素的最高价氧化物溶于水可得到四种溶液,0.010 mol/L的这四种溶液在25℃时的pH与该元素原子半径的关系如图所示。下列说法正确的是

A.简单离子半径:X>Y>Z>W
B.W的氧化物对应的水化物一定是强酸
C.气态氢化物的稳定性:W<Z<Y
D.W与Z可形成一种各原子均达到8电子稳定结构的化合物Z2W2,其结构式为:W-Z-Z-W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行如下实验,研究化学反应中的热量变化。

请回答下列问题:
(1)反应后①中温度升高,②中温度降低。由此判断铝条与盐酸的反应是________反应(填“放热”或“吸热”,下同),Ba(OH)2·8H2O与NH4Cl的反应是________反应。
(2)①中反应的离子方程式是_________,该反应的还原剂是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有氧化还原反应:3H2O2 + 2H2CrO4 =2Cr(OH)3 + 3O2 ↑+ 2H2O
①用单线桥标出反应中的电子转移数目和方向_____________;
②其中Cr被___________,H2O2作___________剂;
③反应转移了0.3mol电子,则产生的气体在标准状态下体积约为__________。
(2)①将用砂纸打磨过的铝片用坩埚钳夹住在酒精灯上点燃,现象是:________;
②在试管中加入少量Na2O2再加入少量水,用带火星的木条伸入试管,再滴入几滴酚酞,可观察到的现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com