
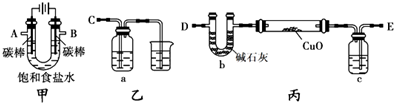
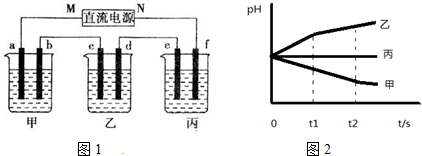
分析 (1)甲装置电解饱和食盐水,左侧碳棒连接电源负极,为阴极,右侧碳棒连接电源正极,为阳极,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大,遇到酚酞溶液变红色;
(2)甲装置中B口导出的气体为氯气,用氢氧化钠溶液吸收氯气,反应生成氯化钠、次氯酸钠与水;
(3)①利用甲、丙装置测定饱和食盐水的电解率,方法Ⅱ通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率,是利用U形管测定氢气还原氧化铜过程中生成的水蒸气,要防止外界空气中的水蒸气等被U形管中碱石灰吸收;
②乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,主要是氢气还原氧化铜过程中不能全部发生反应,造成误差;
(4)根据溶液pH计算氢氧根离子浓度,结合化学方程式计算反应的氯化钠质量,利用溶解度计算150ml溶液中氯化钠的质量,用反应的氯化钠质量除以原溶液中氯化钠质量得到食盐水的电解率.
解答 解:(1)甲装置电解饱和食盐水,左侧碳棒连接电源负极,为阴极,右侧碳棒连接电源正极,为阳极,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大,遇到酚酞溶液变红色,电解过程中甲装置中的实验现象为:左右碳棒上都有气泡产生,左边碳棒附近溶液变红,
故答案为:左右碳棒上都有气泡产生,左边碳棒附近溶液变红;
(2)甲装置中B口导出的气体为氯气,用氢氧化钠溶液吸收氯气,则装置B连C,反应生成氯化钠、次氯酸钠与水,离子方程式为:Cl2+2OH-=H2O+Cl-+ClO-,
故答案为:B;C;Cl2+2OH-=H2O+Cl-+ClO-;
(3)①利用甲、丙装置测定饱和食盐水的电解率,方法Ⅱ通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率,是利用U形管测定氢气还原氧化铜过程中生成的水蒸气,在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,应连接装置D处,
故答案为:D;
②乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,主要是氢气还原氧化铜过程中不能全部发生反应,造成误差,
故答案为:同意,在乙方案中氢气还原氧化铜,氢气不能全部反应,误差太大;
(4)若电解150mL饱和食盐水一段时间,测得溶液的为pH为14,则c(H+)=10-14mol/L,c(OH-)=1mol/L,氢氧根离子物质的量=0.15L×1mol/L=0.15mol,由2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑可知,电解的氯化钠物质的量为0.15mol,其质量=0.15mol×58.5g/mol=8.775g,饱和食盐水密度约为1.33g/mL,150mL饱和食盐水质量=1.33g/mL×150ml=199.5g,溶液中含有溶质氯化钠质量=199.5g×$\frac{36}{100+36}$=52.81g,电解率=$\frac{8.775g}{52.81g}$×100%=16.6%,
故答案为:16.6%.
点评 本题考查电解原理应用、定量测定实验、对装置的分析评价等,关键是对实验原理的理解,侧重考查学生对基础知识的迁移应用,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2O3(Al2O3)用盐酸 | B. | Fe2O3(Al2O3)用氨水 | ||
| C. | Mg(Al)用纯碱溶液 | D. | MgCl2(AlCl3)用氢氧化钠溶液和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
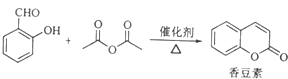
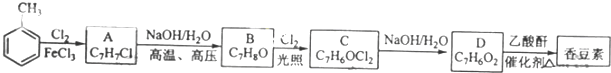
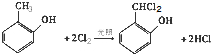 ;
;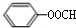 (写结构简式)
(写结构简式)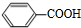 (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | BaO2量不变 | C. | 氧气压强不变 | D. | BaO量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
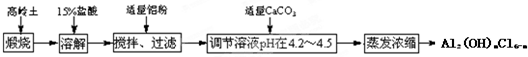
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com