
 来计算硫酸的物质的量,利用Cu+2H2SO4
来计算硫酸的物质的量,利用Cu+2H2SO4 CuSO4+SO2↑+H2O及Cu与稀硫酸不反应来分析;
CuSO4+SO2↑+H2O及Cu与稀硫酸不反应来分析; ×10×NA来计算.
×10×NA来计算.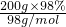 =2mol,Cu与浓硫酸加热发生Cu+2H2SO4
=2mol,Cu与浓硫酸加热发生Cu+2H2SO4 CuSO4+SO2↑+H2O,随反应的进行,浓硫酸变为稀硫酸,但Cu与稀硫酸不反应,则转移的电子数一定小于NA,故A错误;
CuSO4+SO2↑+H2O,随反应的进行,浓硫酸变为稀硫酸,但Cu与稀硫酸不反应,则转移的电子数一定小于NA,故A错误; ×10×NAmol-1=9NA,故D错误;
×10×NAmol-1=9NA,故D错误;

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com