
 ,
, ;
;

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
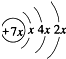 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:查看答案和解析>>
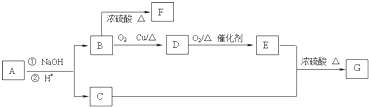
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.
(1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:
 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:
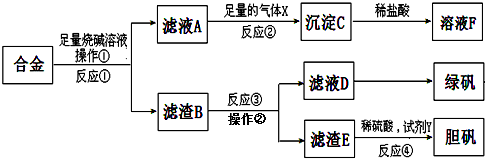
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项实验器材(省略夹持装置)相应实验 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和苯除去NaBr溶液中少量NaI |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体碳酸钠配制0.5mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、酒精灯 | 硫酸铜溶液的浓缩结晶 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com