
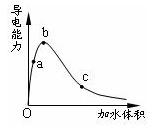
| A.a、b、c三点溶液的pH:c<a<b |
| B.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b |
| C.a、b、c三点中b点n(H+)最大 |
| D.a、b、c三点醋酸的电离程度:a<b<c |
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.H2S 2H+ + S2- 2H+ + S2- | B.HClO = H+ +ClO- |
C.CH3COONH4 NH4+ +CH3COO- NH4+ +CH3COO- | D.HCO3—+H2O  H3O++CO32- H3O++CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 |
| B.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至40℃,再测pH,如果pH变小,则可证明醋酸为弱电解质 |
| C.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH溶液,分别测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸为弱电解质 |
| D.在常温下,配制一定量的CH3COONa溶液,测其pH,若pH大于7,则可证明醋酸为弱电解质。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 镁的质量 | 酸量 | 开始的反应速率 | 产生H2总量 |
| Ⅰ | 0.24g | HCl: 0.2 mol/L 100mL | ν1 | n1 |
| Ⅱ | 0.24g | CH3COOH:0.2 mol/L 100mL | ν2 | n2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.三者浓度相同时,pH大小顺序为③>②>① |
| B.三者浓度相同时,稀释相同倍数,pH变化最大的为② |
| C.三者的pH均为9时,物质的量浓度的大小关系为③>②>① |
| D.三者浓度相同时,分别加入同体积同浓度的盐酸后,pH最大的是① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com