
实验中的下列操作正确的是( )
A.用酒精萃取碘水中的碘
B.蒸馏操作时,温度计的水银球要插入溶液中
C.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干
D.用分液漏斗分离水和四氯化碳时,水从上口倒出,四氯化碳从下口放出
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年四川省高一上学期12月月考化学试卷(解析版) 题型:选择题
取1mol/L的硫酸和盐酸各100mL,分别加入等质量的铁粉,反应后生成的气体质量比为3:2,则往硫酸中加入铁粉的质量为
A、2.8g B、4.2g C、8.4g D、11.2g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:填空题
二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:
2H2(g)+CO(g)  CH3OH(g) ΔH= —90.0 kJ·mol-1 ①
CH3OH(g) ΔH= —90.0 kJ·mol-1 ①
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= —24.5 kJ·mol-1 ②
CH3OCH3(g)+H2O(g) ΔH= —24.5 kJ·mol-1 ②
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH= —
CO2(g)+H2(g) ΔH= — 41.1 kJ·mol-1 ③
41.1 kJ·mol-1 ③
(1)反应①的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下该反应自发进行。
(2)在250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是 (填选项字母)。
A.容器内气体密度保持不变 B.CO与CO2的物质的量之比保持不变
C.H2O与CO2的生成速率之比为1∶1 D.该反应的平衡常数保持不变
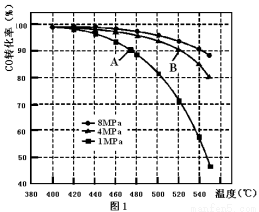
(3)当合成气中CO与H2的物质的量之比恒定时,温度、压强对CO转化率的影响如图1所示。图1中A点的v(逆) B点的v(正)(填“>”、“<”或“=”),说明理由 。实际工业生产中该合成反应的条件为500℃、4MPa请回答采用500℃的可能原因 。
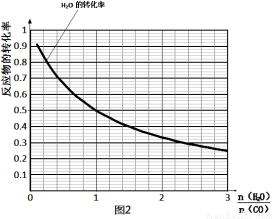
(4)一定温度下,密闭容器中发生反应③,水 蒸气的转化率与n(H2O)∕n(CO)的关系如图:计算该温度下反应③的平衡常数K= 。在图2中作出一氧化碳的转化率与n(H2O)∕n(CO)的曲线。
蒸气的转化率与n(H2O)∕n(CO)的关系如图:计算该温度下反应③的平衡常数K= 。在图2中作出一氧化碳的转化率与n(H2O)∕n(CO)的曲线。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是

A.①是苯,②是CCl4,③是酒精
B.①是酒精,②是CCl4,③是苯
C.①是CCl4,②是苯,③是酒精
D.①是苯,②是酒精,③是CCl4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
下列气体既易溶于水并且水溶液显碱性的是
A.NH3 B.HCl C.SO2 D.CH4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上学期期末化学试卷(解析版) 题型:选择题
下列关于电解槽的叙述中不正确的是( )。
A.与电源正极相连的是电解槽的阴极
B.与电源负极相连的是电解槽的阴极
C.在电解槽的阳极发生氧化反应
D.电子从电源的负极沿导线流入电解槽的阴极
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:填空题
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=﹣116kJ•mol﹣1
CH3OH(g) △H1=﹣116kJ•mol﹣1
(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是___________。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.增大体系压强 d.使用高效催化剂
(2)已知:CO(g)+ O2(g)═CO2(g) △H2=﹣283kJ•mol﹣1
O2(g)═CO2(g) △H2=﹣283kJ•mol﹣1
H2(g)+ O2(g)═H2O(g) △H3=﹣242kJ•mol﹣1
O2(g)═H2O(g) △H3=﹣242kJ•mol﹣1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为________________________。
(3)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.请回答:
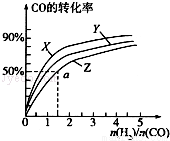
①在图中三条曲线,对应的温度由高到低的顺序是_________________。
②利用a点对应的数据,计算出曲线Z在对应温度下CH3OH(g) CO(g)+2H2(g)的平衡常数:K=_______________。
CO(g)+2H2(g)的平衡常数:K=_______________。
(4)恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中(两容器起始容积相同),充分反应.
①达到平衡所需时间是I_________Ⅱ(填“>”、“<”或“=”,下同).达到平衡后,两容器中CH3OH的体积分数关系是I________Ⅱ。
②平衡时,测得容器I中的压强减小了30%,则该容器中CO的转化率为_______。
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:选择题
下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅(Cl2+H2O Cl-+HClO+H+)
Cl-+HClO+H+)
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,降温或加压有利于氨的合成
D.Fe(SCN)3溶液中加入6mol/LNaOH溶液后颜色变浅
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测二化学试卷(解析版) 题型:选择题
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2 B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1 D.第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com