
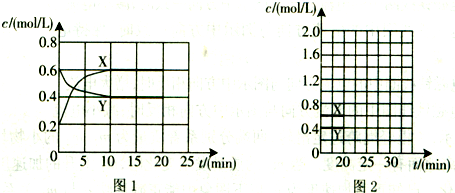
·ÖĪö £Ø1£©ÓÉĶ¼1æÉÖŖ£¬X”¢YµÄÅØ¶Č±ä»ÆĮæÖ®±ČĪŖ2£ŗ1£¬ŌņXĪŖNO2”¢YĪŖN2O4£¬·¢Éś·“Ó¦£ŗN2O4£Øg£©?2NO2£Øg£©£®
£Ø1£©A£®Ėę·“Ó¦½ųŠŠ»ģŗĻĘųĢå×ÜĪļÖŹµÄĮæŌö“ó£¬ŗćĪĀŗćČŻĻĀ£¬ČŻĘ÷ÄŚŃ¹ĒæŌö“ó£¬Ń¹Ēæ²»±äĖµĆ÷µ½“ļĘ½ŗā£»
B£®»ģŗĻĘųĢå×ÜÖŹĮæ²»±ä£¬ČŻĘ÷µÄČŻ»ż²»±ä£¬Ćܶȏ¼ÖÕ²»±ä£»
C£®ČŻĘ÷ÄŚ»ģŗĻĘųĢåµÄŃÕÉ«²»Ėꏱ¼ä±ä»Æ¶ųøı䣬ĖµĆ÷¶žŃõ»ÆµŖµÄÅØ¶Č²»±ä£»
D£®»ģŗĻĘųĢå×ÜÖŹĮæ²»±ä£¬Ėę·“Ó¦½ųŠŠ»ģŗĻĘųĢå×ÜĪļÖŹµÄĮæŌö“ó£¬Ę½¾łĻą¶Ō·Ö×ÓÖŹĮæ¼õŠ”£¬Ę½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±äĖµĆ÷µ½“ļĘ½ŗā£»
£Ø2£©·“Ó¦½ųŠŠµ½10minŹ±£¬²Ī¼Ó·“Ó¦µÄĖÄŃõ»Æ¶žµŖĪŖ1L”Į£Ø0.6-0.4£©mol/L=0.2mol£¬¹²ĪüŹÕČČĮæ11.38kJ£¬¹Ź·“Ó¦1molN2O4¹²ĪüŹÕČČĮæ11.38kJ”Į5=56.9kJ£¬×¢Ć÷ĪļÖŹµÄ¾Ū¼ÆדĢ¬Óė·“Ó¦Čȏ銓ČČ»Æѧ·½³ĢŹ½£»
£Ø3£©Ę½ŗāŹ±c£ØNO2£©=0.6mol/L”¢c£ØN2O4£©=0.4mol/L£¬“śČėK=$\frac{c{\;}^{2}£ØN{O}_{2}£©}{c£Ø{N}_{2}{O}_{4}£©}$¼ĘĖć£»
£Ø4£©¢ŁŗćĪĀŗćČŻĻĀ£¬ŌŁ³äČėŅ»¶ØĮæNO2£¬µČŠ§ĪŖŌö“óŃ¹Ēæ£¬Ę½ŗāÄęĻņŅĘ¶Æ£»
¢Ś20minŹ±Ė²¼äc£ØNO2£©Ōö“ó£¬c£ØN2O4£©²»±ä£¬¶ųŗóĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬c£ØNO2£©¼õŠ”£¬c£ØN2O4£©Ōö“ó£¬10minŗó“ļµ½ŠĀµÄĘ½ŗā£¬“ĖŹ±²āµĆc£ØNO2£©=0.9mol/L£¬øł¾ŻĘ½ŗā³£Źż¼ĘĖćĘ½ŗāŹ±c£ØN2O4£©£¬¾Ż“Ė×÷Ķ¼£®
½ā“š ½ā£ŗ£Ø1£©ÓÉĶ¼1æÉÖŖ£¬X”¢YµÄÅØ¶Č±ä»ÆĮæÖ®±ČĪŖ2£ŗ1£¬ŌņXĪŖNO2”¢YĪŖN2O4£¬·¢Éś·“Ó¦£ŗN2O4£Øg£©?2NO2£Øg£©£®
£Ø1£©A£®Ėę·“Ó¦½ųŠŠ»ģŗĻĘųĢå×ÜĪļÖŹµÄĮæŌö“ó£¬ŗćĪĀŗćČŻĻĀ£¬ČŻĘ÷ÄŚŃ¹ĒæŌö“ó£¬Ń¹Ēæ²»±äĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹAÕżČ·£»
B£®»ģŗĻĘųĢå×ÜÖŹĮæ²»±ä£¬ČŻĘ÷µÄČŻ»ż²»±ä£¬ĆܶČĪŖ³£Źż£¬ĆÜ¶Č²»±ä²»ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹB“ķĪó£»
C£®NO2ĪŖŗģ×ŲÉ«ĘųĢ壬N2O4ĪŖĪŽÉ«ĘųĢå£¬ČŻĘ÷ÄŚ»ģŗĻĘųĢåµÄŃÕÉ«²»Ėꏱ¼ä±ä»Æ¶ųøı䣬ĖµĆ÷¶žŃõ»ÆµŖµÄÅØ¶Č²»±ä£¬·“Ó¦µ½“ļĘ½ŗā£¬¹ŹCÕżČ·£»
D£®»ģŗĻĘųĢå×ÜÖŹĮæ²»±ä£¬Ėę·“Ó¦½ųŠŠ»ģŗĻĘųĢå×ÜĪļÖŹµÄĮæŌö“ó£¬Ę½¾łĻą¶Ō·Ö×ÓÖŹĮæ¼õŠ”£¬Ę½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±äĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹDÕżČ·£¬
¹ŹŃ”£ŗB£»
£Ø2£©·“Ó¦½ųŠŠµ½10minŹ±£¬²Ī¼Ó·“Ó¦µÄĖÄŃõ»Æ¶žµŖĪŖ1L”Į£Ø0.6-0.4£©mol/L=0.2mol£¬¹²ĪüŹÕČČĮæ11.38kJ£¬¹Ź·“Ó¦1molN2O4¹²ĪüŹÕČČĮæ11.38kJ”Į5=56.9kJ£¬¹ŹøĆ·“Ó¦ČČ»Æѧ·½³ĢŹ½ĪŖ£ŗN2O4£Øg£©?2NO2£Øg£©”÷H=+56.9kJ/mol£¬
¹Ź“š°øĪŖ£ŗN2O4£Øg£©?2NO2£Øg£©”÷H=+56.9kJ/mol£»
£Ø3£©Ę½ŗāŹ±c£ØNO2£©=0.6mol/L”¢c£ØN2O4£©=0.4mol/L£¬ŌņĘ½ŗā³£ŹżK=$\frac{{c}^{2}£ØN{O}_{2}£©}{c£Ø{N}_{2}{O}_{4}£©}$=$\frac{0£®{6}^{2}}{0.4}$=0.9£¬
¹Ź“š°øĪŖ£ŗ0.9£»
£Ø4£©¢ŁŗćĪĀŗćČŻĻĀ£¬ŌŁ³äČėŅ»¶ØĮæNO2£¬µČŠ§ĪŖŌö“óŃ¹Ēæ£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ŠĀĘ½ŗāŗó»ģŗĻĘųĢåÖŠNO2µÄĢå»ż·ÖŹż¼õŠ”£¬¹ŹW1£¾W2£¬
¹Ź“š°øĪŖ£ŗ£¾£»
¢Ś20minŹ±Ė²¼äc£ØNO2£©Ōö“ó£¬c£ØN2O4£©²»±ä£¬¶ųŗóĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬c£ØNO2£©¼õŠ”£¬c£ØN2O4£©Ōö“ó£¬10minŗó“ļµ½ŠĀµÄĘ½ŗā£¬“ĖŹ±²āµĆc£ØNO2£©=0.9mol/L£¬ÓÉÓŚK=$\frac{{c}^{2}£ØN{O}_{2}£©}{c£Ø{N}_{2}{O}_{4}£©}$=0.9£¬ŌņĘ½ŗāŹ±c£ØN2O4£©=$\frac{0£®{9}^{2}}{0.9}$mol/L=0.9mol/L£¬¶ųXĪŖNO2”¢YĪŖN2O4£¬20minŗóø÷ĪļÖŹµÄÅضČĖꏱ¼ä±ä»ÆµÄĒśĻßĪŖ£ŗ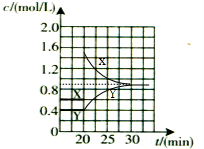 £¬
£¬
¹Ź“š°øĪŖ£ŗ £®
£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗā¼ĘĖćÓėÓ°ĻģŅņĖŲ”¢»ÆŃ§Ę½ŗāדĢ¬ÅŠ¶Ļ”¢Ę½ŗā³£ŹżµČ£¬£Ø4£©ÖŠ×÷Ķ¼ĪŖŅדķµć£¬×¢ŅāŌŁ“ĪĘ½ŗāŹ±ø÷ĪļÖŹµÄÅØ¶Č”¢Ģõ¼žøıäĖ²¼äø÷ĪļÖŹµÄÅØ¶Č£¬ÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
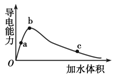 Ņ»¶ØĪĀ¶ČĻĀ£¬½«Ņ»¶ØĮæµÄ±ł“×Ėį¼ÓĖ®Ļ”ŹĶ£¬Ļ”ŹĶ¹ż³ĢÖŠČÜŅŗµÄµ¼µēŠŌ±ä»ÆČēĶ¼ĖłŹ¾£®
Ņ»¶ØĪĀ¶ČĻĀ£¬½«Ņ»¶ØĮæµÄ±ł“×Ėį¼ÓĖ®Ļ”ŹĶ£¬Ļ”ŹĶ¹ż³ĢÖŠČÜŅŗµÄµ¼µēŠŌ±ä»ÆČēĶ¼ĖłŹ¾£®| A£® | “×ĖįµÄµēĄė³Ģ¶Č£ŗa£¼b£¼c | |
| B£® | ČÜŅŗµÄpHÖµ£ŗb£¼a£¼c | |
| C£® | ÕŗČ”aµćČÜŅŗµĪŌŚŹŖČóµÄpHŹŌÖ½ÉĻ£¬²āµĆpHÖµŅ»¶ØĘ«“ó | |
| D£® | Čō·Ö±šČ”a”¢b”¢cČżµćµÄČÜŅŗø÷10 mL£¬ø÷ÓĆĶ¬ÅØ¶ČµÄĒāŃõ»ÆÄĘČÜŅŗÖŠŗĶ£¬ĻūŗÄNaOHČÜŅŗµÄĢå»ża£¾b£¾c |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
| ŹµŃ鱹ŗÅ | ĪĀ¶Č | Ź±¼ä/min ĪļÖŹµÄĮæ | 0 | 10 | 20 | 40 | 50 |
| 1 | 130”ę | n£ØCH4£©/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180”ę | n£ØCH4£©/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ±ąŗÅ | ĪĀ¶Č£Ø”ę£© | ĘšŹ¼ĪļÖŹµÄĮæ £Ømol£© | Ę½ŗāĪļÖŹµÄĮæ £Ømol£© | “ļµ½Ę½ŗāĖłŠčŹ±£Øs£© | |
| PCl5£Øg£© | PCl3£Øg£© | Cl2£Øg£© | |||
| ¢ń | 320 | 0.40 | 0.10 | 0.10 | t1 |
| ¢ņ | 320 | 0.80 | t2 | ||
| ¢ó | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A£® | Ę½ŗā³£ŹżK£ŗČŻĘ÷¢ņ£¾ČŻĘ÷¢ó | |
| B£® | ·“Ó¦µ½“ļĘ½ŗāŹ±£¬PCl5µÄ×Ŗ»ÆĀŹ£ŗČŻĘ÷¢ņ£¾ČŻĘ÷¢ń | |
| C£® | ·“Ó¦µ½“ļĘ½ŗāŹ±£¬ČŻĘ÷¢ńÖŠµÄĘ½¾łĖŁĀŹĪŖv£ØPCl5£©=$\frac{0.01}{{t}_{1}}$mol/£ØL•s£© | |
| D£® | ĘšŹ¼Ź±ĻņČŻĘ÷¢óÖŠ³äČėPCl5 0.30 mol”¢PCl30.45 molŗĶCl20.10 mol£¬Ōņ·“Ó¦½«ĻņÄę·“Ó¦·½Ļņ½ųŠŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ź±¼ä/min | 0 | 10 | 20 | 30 | 40 |
| n£ØX£©/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n£ØY£©/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A£® | ·“Ó¦ŌŚĒ°10 minµÄĘ½¾łĖŁĀŹĪŖv£ØZ£©=0.01mol•L-1•min-1 | |
| B£® | ±£³ÖĘäĖūĢõ¼ž²»±ä£¬½µµĶĪĀ¶Č£¬Ę½ŗāŹ±£¬c£ØX£©=0.08mol•L-1£¬Ōņa£¾0 | |
| C£® | ŗćŃ¹£¬ĘäĖūĢõ¼ž²»±ä£¬ĻņČŻĘ÷ÖŠ³äČė²»²ĪÓė·“Ó¦µÄµŖĘų×÷ĪŖĻ”ŹĶ¼Į£¬XµÄ×Ŗ»ÆĀŹ“óÓŚ50.0% | |
| D£® | ±£³ÖĘäĖüĢõ¼ž²»±ä£¬ŌŁĻņČŻĘ÷ÖŠ³äČė0.10 mol YŗĶ0.10 mol Z£¬“ļµ½Ę½ŗāŗó£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ0.2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ū | B£® | ¢Ż | C£® | ¢Ś¢Ż | D£® | ¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĖÄĀČ»ÆĢ¼ŗĶĖ®£¬±½ŗĶĖ® | B£® | ĘūÓĶŗĶĖ®£¬ŅŅ“¼ŗĶĖ® | ||
| C£® | ŅŅ“¼ŗĶĖ®£¬Ö²ĪļÓĶŗĶĖ® | D£® | “×ĖįŗĶĖ®£¬¾Ę¾«ŗĶĖ® |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com