
| A、11.85g |
| B、12.7g |
| C、27.45g |
| D、28.3g |
| V |
| Vm |
| V |
| Vm |
| 6.72L |
| 22.4L/mol |
| 0.3×2 |
| 3 |
| 6.72L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、pH=6的溶液一定呈酸性 |
| B、25℃时,pH=7的一定是纯水 |
| C、溶于水呈中性的盐一定未发生水解 |
| D、酸碱恰好中和时,溶液不一定为中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol 氧气中含有6.02×1023个氧原子,在标准状况下占有体积22.4 L |
| B、1 mol臭氧和1.5 mol氧气含有相同的氧原子数 |
| C、等体积、浓度均为1 mol/L的硫酸和盐酸,电离出的氢离子数之比为2:1 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50mL 0.2mol?L-1 的 NaCl 溶液 |
| B、100mL 0.1mol?L-1 的 NaCl 溶液 |
| C、25mL 0.2mol?L-1 的 Na2SO4 溶液 |
| D、10mL 0.5mol?L-1 的 Na2CO3 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
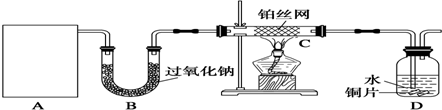

查看答案和解析>>
科目:高中化学 来源: 题型:
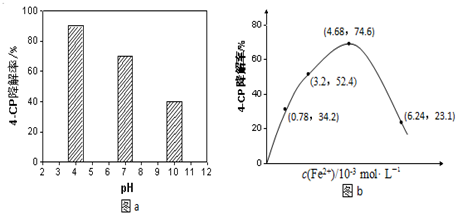
查看答案和解析>>
科目:高中化学 来源: 题型:
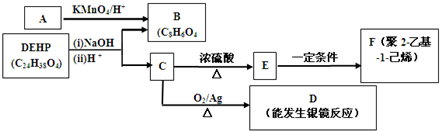
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热 |
| B、加入少量K2SO4溶液 |
| C、用粗锌(含铜、银)而不用纯锌 |
| D、滴加少量CuSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com