
分析 酸雨的pH小于5.6,二氧化碳与水反应生成碳酸,溶液呈酸性,PH约为5.6,当雨水中溶解二氧化硫或二氧化氮等气体时,最终生成硫酸、硝酸等强酸,溶液酸性较强而导致雨水PH小于5.6;
硫酸型酸雨的形成过程:
途经一:当雨水的pH<5.6时称为酸雨,硫酸型“酸雨”的形成过程可近似地看成是:排放到空气中的二氧化硫与潮湿空气中的氧气和水蒸气,在空气中粉尘的催化下化合生成硫酸;
途径二:是空气中的二氧化硫气体在粉尘做催化剂的条件下生成三氧化硫,三氧化硫再与雨水形成酸雨.
解答 解:二氧化碳微溶于水,正常雨水溶解少量二氧化碳气体,二氧化碳与水反应生成碳酸,溶液呈酸性,PH约为5.6,当雨水中溶解二氧化硫或二氧化氮等气体时,最终生成硫酸、硝酸等强酸,溶液酸性较强而导致雨水PH小于5.6.
途径一:空气中的SO2可与雨水反应,发生SO2+H2O?H2SO3,H2SO3进一步被氧气氧化生成H2SO4,其反应方程式为:2H2SO3+O2=2H2SO4,硫酸溶在雨水中,使雨水呈酸性,形成酸雨;
途径二:空气中的二氧化硫气体在粉尘做催化剂的条件下生成三氧化硫,三氧化硫再与雨水形成酸雨,故化学方程式为:2SO2+O2$\frac{\underline{\;浮尘\;}}{\;}$2SO3;SO3+H2O=H2SO4;
故答案为:酸;5.6;大气中的二氧化碳溶于雨水;小于5.6;硫氧化物;氮氧化物;SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4;2SO2+O2$\frac{\underline{\;浮尘\;}}{\;}$2SO3;SO3+H2O=H2SO4.
点评 本题考查了酸雨形成的过程分析,正确找出反应物、生成物、反应条件,正确书写化学方程式;掌握酸的化学性质,题目较简单.


科目:高中化学 来源: 题型:选择题
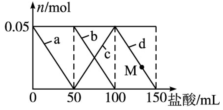 向100mL含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向100mL含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )| A. | a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)3↓ | |
| B. | b曲线表示碳酸钠和盐酸反应,d曲线表示氢氧化铝的溶解 | |
| C. | M点时,溶液中沉淀的质量小于3.9 g | |
| D. | 原混合溶液中的Na2CO3溶液的浓度为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶粒可以导电 | B. | 胶体有丁达尔效应 | ||
| C. | 胶体粒子大小在1~100nm之间 | D. | 胶体的分散剂为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂 | 试纸/试液 | 现象 | 结论 |
| A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
| B | 浓盐酸、浓硫酸 | 紫色石蕊试纸 | 变红 | HCl为酸性气体 |
| C | 浓盐酸、二氧化锰 | 淀粉碘化钾试纸 | 变蓝 | Cl2具有氧化性 |
| D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | |
| H2 | CO2 | HCOOH | |||
| Ⅰ | 150 | 0.4 | 0.4 | 0.2 | 2 |
| Ⅱ | 150 | 0.8 | 0.8 | t1 | |
| Ⅲ | 0.4 | 0.4 | 0.16 | t2 | |
| A. | 反应达到平衡时,容器Ⅰ中的平均反应速率为v(H2)=0.1mol/(L•min) | |
| B. | 反应达到平衡时,容器Ⅱ所需时间t2<2min | |
| C. | 若只改变一个反应条件,容器Ⅲ可能是加入了合适的催化剂 | |
| D. | 起始时,向容器Ⅱ中充入0.45mol H2、0.20mol CO2和0.18molHCOOH,则反应向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
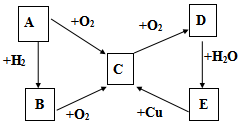 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
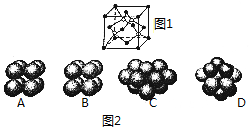 (1)碳化硅的晶胞结构(如图1)与金刚石类似(其中“●”为碳原子,“○”为硅原子).图2中“●”点构成的堆积方式与下列图示中D所表示的堆积方式相同
(1)碳化硅的晶胞结构(如图1)与金刚石类似(其中“●”为碳原子,“○”为硅原子).图2中“●”点构成的堆积方式与下列图示中D所表示的堆积方式相同查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H6和C5H8的烃 | B. | 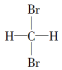 和 和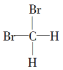 | ||
| C. | 符合CnH2n通式的烃 | D. | 分子式为C4H10和C20H42的烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com