
【题目】现有碳酸钠和碳酸氢钠的固体混合物,先取m g固体样品进行加热,完全分解产生CO2气体112 mL;另取m g固体样品溶于水,加入足量的盐酸时产生CO2 448 mL(气体体积均为标准状况下测定)。
(1)求m g混合物中碳酸氢钠与碳酸钠的物质的量各是多少?_________
(2)若产生448 mL CO2时,消耗盐酸的体积为300mL,则该盐酸的物质的量浓度是多少?____________
【答案】 0.01mol ,0.01mol 0.10 mol·L-1
【解析】完全分解产生CO2气体112 mL,物质的量为![]() =0.005mol,
=0.005mol,
2NaHCO3![]() Na2CO3 + CO2↑+H2O
Na2CO3 + CO2↑+H2O
0.01mol 0.005mol 0.005mol
根据加热分解产生的CO2体积可以计算样品中NaHCO3的物质的量为0.01mol,
加入足量的盐酸时产生CO2 448 mL,物质的量为![]() =0.02mol,
=0.02mol,
加入足量的稀盐酸时发生了如下反应:Na2CO3+2HCl=2NaCl+ CO2↑+H2O、HCl +NaHCO3= NaCl+CO2↑+H2O,根据碳元素守恒可知n(Na2CO3)=0.02mol-0.01mol=0.01mol,(1)m g混合物中碳酸氢钠与碳酸钠的物质的量均为0.01mol;(2)若产生448 mL CO2时,消耗盐酸的体积为300mL,因n(HCl)=0.01mol×2+0.01mol=0.03mol,c(HCl)= ![]() =0.10mol/L。
=0.10mol/L。


科目:高中化学 来源: 题型:
【题目】试回答下列各题: 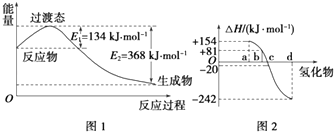
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJmol﹣1
请填空:
共价键 | H﹣H | Cl﹣Cl | H﹣Cl |
键能/(kJmol﹣1) | 436 | 247 |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式: .
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25kJmol﹣1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=﹣47kJmol﹣1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJmol﹣1③
请写出CO还原FeO的热化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( ) 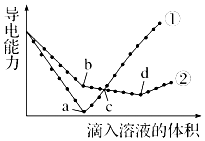
A.①代表滴加H2SO4溶液的变化曲线
B.b点,水电离产生的c(H+)<10﹣7mol/L
C.c点,两溶液中含有相同量的 OH﹣
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关判断的依据正确的是( )
A.电解质:水溶液是否导电
B.原子晶体:构成晶体的微粒是否是原子
C.共价分子:分子中原子间是否全部是共价键
D.化学平衡状态:平衡体系中各组分的物质的量浓度是否相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成下列实验的是
①检验自来水中是否含氯离子 ②鉴别食盐和小苏打 ③蛋壳能否溶于酸 ④白酒中是否含甲醇
A. ①②B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示AlCl3溶液与NaOH溶液相互滴加混合,由图中判断错误的是( )

A. ①线表示Al3+物质的量的变化
B. x表示AlCl3的物质的量
C. ③线表示Al(OH)3物质的量的变化
D. ④线表示AlO![]() 物质的量的变化
物质的量的变化
【答案】B
【解析】假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗![]() molAl3+,生成
molAl3+,生成![]() molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
molAl(OH)3↓,前后两部分消耗的Al3+为1mol: ![]() mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少,①线表示Al3+的物质的量的变化,选项A正确;B.由上述分析可知,x表示NaOH溶液,选项B错误;C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,后减小,故②③线表示Al(OH)3的物质的量的变化,选项C正确;D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,④线表示AlO2-的物质的量的变化,选项D正确。答案选B。
mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少,①线表示Al3+的物质的量的变化,选项A正确;B.由上述分析可知,x表示NaOH溶液,选项B错误;C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,后减小,故②③线表示Al(OH)3的物质的量的变化,选项C正确;D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,④线表示AlO2-的物质的量的变化,选项D正确。答案选B。
点睛:本题考查镁铝重要化合物、离子反应、化学计算等,根据相互滴加过程离子物质的量的变化确定图象表示向AlCl3溶液中滴加NaOH溶液是解题的关键。假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗![]() molAl3+,生成
molAl3+,生成![]() molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
molAl(OH)3↓,前后两部分消耗的Al3+为1mol: ![]() mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答。
mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答。
【题型】单选题
【结束】
17
【题目】(1)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
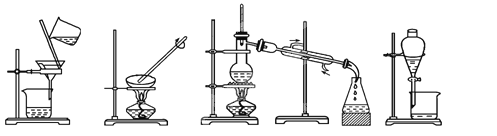
① ② ③ ④
从海水中提取水:____________;从KCl溶液中获取KCl晶体:____________;
分离CaCO3和水:____________;分离植物油和水:____________。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
实验① | 实验② | 实验③ | |
取甲瓶溶液的量 | 400 mL | 120 mL | 120 mL |
取乙瓶溶液的量 | 120 mL | 440 mL | 400 mL |
生成沉淀的量 | 1.56 g | 1.56 g | 3.12 g |
①甲瓶溶液为________溶液。
②乙瓶溶液为________溶液,其物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0L恒容密闭容器中充入2molSO2和1molO2 , 发生反应:2SO2(g)+O2(g)2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前t1s的平均速率v(O2)=0.4/t1molL﹣1s﹣1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.保持温度不变,向该容器中再充入0.3 molSO2、0.1molO2和0.2molSO3 , 则此时V正>V逆
D.相同温度下,起始时向容器中充入4mol SO3 , 达到平衡时,SO3的转化率大于10%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com