
分析 相同条件下,密度之比等于相对分子质量之比,据此计算出该有机物的相对分子质量,计算有机物的物质的量,通过碱石灰增重为燃烧生成二氧化碳与水的质量,结合二者物质相等计算二氧化碳、水的物质的量,根据原子守恒确定分子中C、H原子数目,再结合相对分子质量确定O原子数目,进而确定有机物的分子式;
该有机物能与银氨溶液反应,说明含有醛基(或甲酸形成的酯基),可在酸或者碱催化下水解,含有酯基,且含有手性碳原子,结合分子式确定可能的结构简式.
解答 解:(1)该有机物的相对分子质量=3.52×29=102,所取得有机物的物质的量为=$\frac{4.08g}{102g/mol}$=0.04mol,
充分燃烧后产生的CO2和H2O的物质的量之比为1:1,设燃烧生成CO2、H2O的物质的量为xmol,则:44x+18x=12.4,解得:x=0.2,
故有机物分子中含有C原子数目为:$\frac{0.2mol}{0.04mol}$=5,含有H原子数目为:$\frac{0.2mol×2}{0.04mol}$=10,则含有O原子数目为$\frac{102-12×5-10}{16}$=2,故设有机物分子式为C5H10O2,
答:该有机物的分子式为C5H10O2.
(2)该有机物能与银氨溶液反应,可在酸或者碱催化下水解,说明含有甲酸形成的酯基,且含有手性碳原子,故该有机物结构简式为:HCOOCH(CH3)CH2CH3,
答:该有机物结构简式为HCOOCH(CH3)CH2CH3.
点评 本题考查有机物分子式与结构确定、限制条件同分异构体书写,掌握燃烧法利用原子守恒确定有机物分子组成.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏目的是将含碳原子数较少的烃先气化经冷凝而分离出来 | |
| B. | 石油经过常、减压分馏、裂化等工序炼制后即能制得纯净物 | |
| C. | 石油的裂化是把相对分子质量较大的烃分子断裂为相对分子质量较小的烃分子 | |
| D. | 工业上通过石油裂解制取大量乙烯、丙烯,乙炔;通过石油催化重整获取芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合理利用太阳能、风能和氢能等能源有利于实现“低碳经济” | |
| B. | 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 | |
| C. | 利用可降解塑料可缓解白色污染 | |
| D. | 煤炭是清洁燃料,可直接燃烧,大量使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v正(N2)=3v逆(H2) | B. | v正(N2)=3v正(H2) | C. | 2v正(H2)=3 v逆(NH3) | D. | v正(N2)=v逆(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
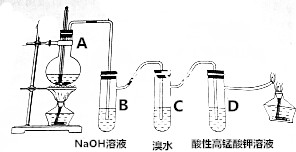
| A. | 乙烯中既有离子键又有共价键 | |
| B. | 装置B中的离子方程式:SO2+2OH-═SO42-+H2O | |
| C. | 装置C中乙烯发生取代反应生成氢溴酸,使溶液的酸性增强 | |
| D. | 装置D中溶液的紫色褪去,乙烯发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐减小 | B. | 电子层数逐渐增多 | ||
| C. | 最高正化合价逐渐增大 | D. | 元素的非金属性逐渐减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com