
| A. | 500mL溶液中所含K+、SO42-总数为0.3NA | |
| B. | 500mL溶液中含有0.1NA个K+ | |
| C. | 1L溶液中K+浓度为0.2 mol/L | |
| D. | 1L溶液中SO42-的浓度为0.4 mol/L |
分析 A.根据n=cV计算硫酸钾的物质的量,然后计算出含有钾离子和硫酸根离子的物质的量及数目;
B.根据A的计算结果可知含有钾离子的物质的量及数目;
C.根据c(K+)=2c(K2SO4)计算;
D.根据c(SO42-)=c(K2SO4)计算.
解答 解:A.500mL0.2mol/LK2SO4溶液中含有硫酸钾的物质的量为:0.2mol/L×0.5L=0.1mol,0.1mol硫酸钾中含有0.2mol钾离子、0.1mol硫酸根离子,总共含有0.3mol离子,含有K+、SO42-总数为0.3NA,故A正确;
B.根据A可知,500mL溶液中含有0.2mol钾离子,含有0.2NA个K+,故B错误;
C.1L溶液中K+浓度为:c(K+)=2c(K2SO4)=0.4 mol/L,故C错误;
D.1L溶液中SO42-的浓度为:c(SO42-)=c(K2SO4)=0.2 mol/L,故D错误;
故选A.
点评 本题考查物质的量的计算,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
 Ⅰ红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
Ⅰ红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1 mol阿司匹林最多可消耗2 mol NaOH | |
| B. | 阿司匹林的分子式为C9H10O4 | |
| C. | 水杨酸可以发生取代、加成、氧化、加聚反应 | |
| D. | 服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向明矾溶液中溶液中加入足量的浓氨水 | 证明氢氧化铝溶于氨水 |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向硅酸钠溶液中通入足量的CO2出现白色沉淀. | 酸性:H2CO3>H2SiO3 |
| D | 室温下,用pH试纸测得:0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. | HSO3-结合H+的能力比 SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 4.0 g重水(D2O)中所含质子数为2NA | |
| B. | 4.48 L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 常温常压下16g的氧气与臭氧混合气体中,氧原子数为NA | |
| D. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
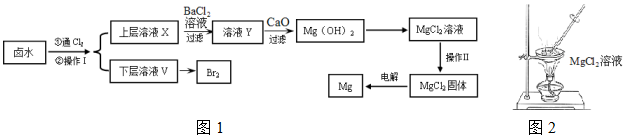
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: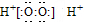 | |
| B. | 氮原子最外层电子轨道表达式: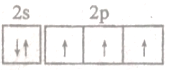 | |
| C. | Cl中子数为18的氯原子结构示意图: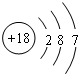 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3?Na++H++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com