
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
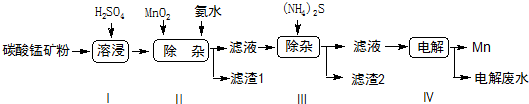
分析 向碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)中加入硫酸,可以发生反应生成硫酸盐,向其中就如具有氧化性的二氧化锰,可以将亚铁离子氧化为铁离子,调节pH可以将氢氧化铁沉淀下来,向滤液中加入硫化铵,可以将镍离子、钴离子形成硫化物沉淀下来,最后对得到的含有锰离子的盐电解,可以得到金属锰.
(1)加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水;
(2)据得失电子守恒有MnO2+2Fe2+--Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+--Mn2++2Fe3+,最后据原子守恒得MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
(4)由于第二次过滤后的滤液中主要含有NiSO4,电解该溶液时Ni2+在阴极上被还原:Mn2++2e-=Mn;
(5)Mn的燃烧热是1molMn完全燃烧生成稳定氧化物MnO2(s)放出的热量,结合热化学方程式和盖斯定律计算得到;
(6)按照图示流程,含MnCO3质量分数为57.5%的碳酸锰矿a kg,最终得到Mn的质量为110b kg,忽略中间过程的损耗,除杂质时,所引入的锰元素和原来碳酸锰中锰元素总和为110b kg,据此列式计算;
解答 解:(1)加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水,步骤Ⅰ中,MnCO3与硫酸反应的化学方程式为:MnCO3+H2SO4=MnSO4+CO2↑+H2O;
故答案为:MnCO3+H2SO4=MnSO4+CO2↑+H2O;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是据得失电子守恒有MnO2+2Fe2+-Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+-Mn2++2Fe3+,最后据原子守恒得,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
故答案为:CoS和NiS;
(4)由于第二次过滤后的滤液中主要含有NiSO4,电解该溶液时Ni2+在阴极上被还原:Mn2++2e-=Mn;
故答案为:阴,Mn2++2e-=Mn;
(5)①S(s)+O2(g)=SO2(g)△H=a kJ•mol-1
②Mn(s)+S(s)+2O2(g)=MnSO4(s)△H=b kJ•mol-1
③MnO2(s)+SO2(g)=MnSO4(s)△H=c kJ•mol-1,则Mn的燃烧热
盖斯定律计算得到②-①-③得到Mn(s)+O2(g)=MnO2(s)△H=-( a+c-b)kJ•mol-1
故答案为:-(a+c-b) kJ•mol-1;
(6)按照图示流程,含MnCO3质量分数为57.5%的碳酸锰矿a kg,最终得到Mn的质量为110b kg,忽略中间过程的损耗,除杂质时,所引入的锰元素和原来碳酸锰中锰元素总和为110b kg,设引入的锰元素相当于MnO2物质的量为x,
$\frac{a×57.5%}{115}$+x=$\frac{110b}{55}$
x=$\frac{110b}{55}$-$\frac{a×57.5%}{115}$
相当于MnO2质量=($\frac{110b}{55}$-$\frac{a×57.5%}{115}$)×87=(174b-0.435a )kg
故答案为:174b-0.435a;
点评 本题考查了物质分离的流程分析,物质性质,分离提纯物质的实验设计和本质分析应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 2:5 | C. | 3:4 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 硝酸铵溶于水温度降低,这个过程吸热热量 | |
| C. | 同温同压下,H2和Cl2在光照和点燃条件下的△H不同 | |
| D. | 自发反应的熵一定增大,非自发反应的熵一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
 | i有黄色沉淀出现,随着Na2SO3溶液的滴入,沉淀增加,当加到5mL时,溶液的蓝色消失. ii将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生. iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当加到10mL时,沉淀完全溶解,得无色溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
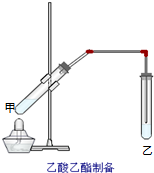 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com