
| A. | 沸腾炉 | B. | 接触室 | C. | 高炉 | D. | 吸收塔 |
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:多选题
| A. | 单质钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 纯碱溶液与盐酸反应:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| C. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| D. | 稀硫酸和氢氧化钡溶液反应:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸酸化的硝酸钡溶液 | B. | 先加硝酸酸化,再加入硝酸钡溶液 | ||
| C. | 加盐酸酸化了的BaCl2溶液 | D. | 先加盐酸酸化,再加入BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中,加入热的蒸馏水,充分搅拌直到固体不再溶解. |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
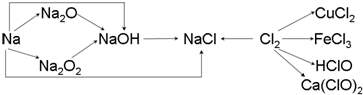
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y和Z互为同位素 | |
| B. | X和Y能化合成两种化合物 | |
| C. | X和Y化合的产物中一定不含有共价键 | |
| D. | X离子比R的离子半径大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com