
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
| 方法c | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
| 序号 | 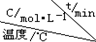 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
分析 (1)根据盖斯定律结合热化学方程式的书写方法来书写;
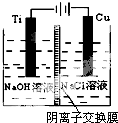
(2)方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子浓度,在电解池的阳极发生失电子的氧化反应;钛极是阴极发生氢离子得电子的还原反应,据此分析附近pH值变化;
(3)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式;
(4)①该反应的正反应是吸热反应,升高温度平衡正向移动,水蒸气的转化率增大;温度不同,反应速率不同,不能通过对比实验①③到达平衡所需时间长短判断;
②先计算水蒸气反应速率,再根据同一反应中同一段时间内各物质的反应速率之比等于其计量数之比计算氧气反应速率.
③催化剂效率越高,反应速率越快,到达平衡时间越短.
解答 解:(1)已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s);△H=-169kJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-110.5kJ•mol-1,
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-157kJ•mol-1
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO (s)=Cu2O(s)+CO(g)
该反应可以是②-③×2-$\frac{1}{2}$×①,反应的焓变是-110.5kJ•mol-1-(-157kJ•mol-1×2)-$\frac{1}{2}$×(-169kJ•mol-1)=34.5kJ•mol-1,
故答案为:C(s)+2CuO (s)=Cu2O(s)+CO(g)△H=+34.5kJ•mol-1;
(2)方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子浓度;在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,钛极是阴极发生氢离子得电子的还原反应,所以消耗氢离子,则PH值增大,故答案为:阴;2Cu-2e-+2OH-=Cu2O+H2O;增大;
(3)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O,
故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O;
(4)①该反应的正反应是吸热反应,升高温度平衡正向移动,水蒸气的转化率增大,②和③相比,③转化率高,所以T2>T1,温度不同,反应速率不同,不能通过对比实验①③到达平衡所需时间长短判断;
故答案为:>;否;
②前20min内水蒸气反应速率=$\frac{0.05-0.0486}{20-0}$mol/(L.min)=7×10-5mol/(L•min),
同一反应中同一段时间内各物质的反应速率之比等于其计量数之比,则氧气反应速率=3.5×10-5mol/(L•min),
故答案为:3.5×10-5mol/(L•min);
③实验①②相比,实验②到达平衡时间短,反应速率越快,催化剂效率高,
故答案为:<.
点评 本题考查物质制备,为高频考点,涉及化学平衡有关计算、电解原理、盖斯定律等知识点,侧重考查学生分析计算能力,难点是电极反应式的书写,题目难度中等.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对叔丁基苯酚(
对叔丁基苯酚(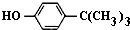 )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如下:
1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如下:| 相对分 子质量 | 密度 /g•mL-1 | 沸点/℃ | 水中 溶解性 | |
| 正丙醇 | 60 | 0.896 | 97.1 | 溶 |
| 正丙醚 | 102 | 0.74 | 90 | 几乎不溶 |
| 1-溴丙烷 | 123 | 1.36 | 71 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
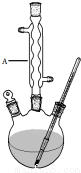 水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(结构简式为
水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(结构简式为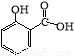 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
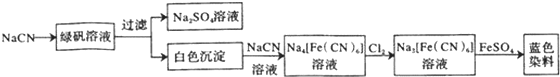
 .
.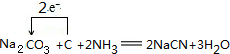 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
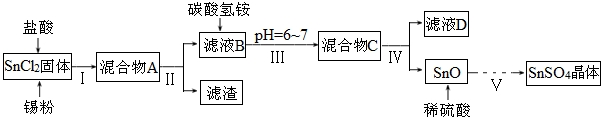
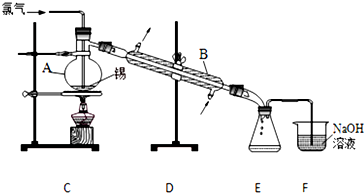
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com