
 .NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.
.NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.分析 Ⅰ.镓是31号元素,该原子核外有31个电子,根据能量最低原理书写核外电子排布式;
Zn原子的4s轨道为全充满状态,较稳定,第一电离能较高;
Ⅱ.(1)C、O原子都符合8电子稳定结构,C原子与氧原子之间存在2个普通共价键、1个配位键,C原子与氧原子之间形成三键;
NH3分子中N原子成3个N-H键、含有1对孤电子对,据此确定N原子杂化方式及空间结构;
(2)向盛有硫酸铜水溶液的试管里加入氨水,首先形成氢氧化铜沉淀,继续加氨水,氢氧化铜溶解得到四氨合铜络离子,溶液呈深蓝色透明溶液,若加入极性较小的溶剂乙醇,生成的[Cu(NH3)4]SO4析出得到深蓝色的晶体.
解答 解:Ⅰ.镓是31号元素,该原子核外有31个电子,4S能级能量小于3d能级能量,根据能量最低原理,电子先排4s能级后排3d能级,所以其核外电子排布式为1s22s22p63s23p63d104s24p1;
Zn原子的价电子排布式为3d104s2,4s轨道为全充满状态,较稳定,故Zn的第一电离能大于Ga,
故答案为:1s22s22p63s23p63d104s24p1;Zn原子的价电子排布式为3d104s2,4s轨道为全充满状态,体系的能量较低,较稳定,故Zn的第一电离能大于Ga;
Ⅱ.(1)C、O原子都符合8电子稳定结构,C原子与氧原子之间存在2个普通共价键、1个配位键,C原子与氧原子之间形成三键,结构式为 ;
;
NH3分子中N原子成3个N-H键、含有1对孤电子对,N原子杂化方式为sp3,空间结构为三角锥形,
故答案为: ;sp3;三角锥形;
;sp3;三角锥形;
(2)氢氧化铜与氨水发生反应:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,沉淀溶解,向该溶液中加乙醇,生成的[Cu(NH3)4]SO4在极性极性的乙醇中溶解度减小而析出得到深蓝色的晶体,
故答案为:氢氧化铜与氨水发生反应:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,向该溶液中加乙醇,生成的[Cu(NH3)4]SO4在极性极性的乙醇中溶解度减小而析出得到深蓝色的晶体.
点评 本题是对物质结构的考查,涉及核外电子排布式、电离能、分子结构、杂化轨道、配合物等,难度中等,注意理解同周期第一电离能异常原因.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②④⑤⑥⑦ | C. | ②④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 其中钠离子的浓度为0.2mol•L-1 | |
| B. | 溶液中的OH-浓度大于H+浓度,HCO3-的浓度小于CO32-的浓度 | |
| C. | 溶液中Na+的浓度等于CO32-浓度的二倍 | |
| D. | 溶液中H2CO3分子的浓度为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
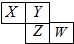 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )| A. | 原子半径由大到小排列顺序Z>X>Y | |
| B. | Y元素的两种同素异形体在常温下都是气体 | |
| C. | 最高价氧化物对应水化物的酸性W>Z | |
| D. | 阴离子半径由大到小排列顺序X>Y>Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| B. | 化合物YX、ZX2、WX3中化学键的类型相同 | |
| C. | 元素X的简单气态氢化物的沸点比W的高 | |
| D. | 简单离子半径的大小顺序:rW>rY>rX |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com