
| 化学键 | H-H | H-Cl | H-Br | CI-CI | Br-Br |
| 键能( KJ•mol-1) | 436 | 431 | 299 | 247 | 193 |
| A. | HCl | B. | HBr | C. | H2 | D. | Br2 |
科目:高中化学 来源: 题型:推断题

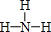 .②的简单气态氢化物的电子式为
.②的简单气态氢化物的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应放出197 kJ 的热量 | |
| B. | 生成SO3为2 mol | |
| C. | SO2和SO3物质的量之和为2 mol | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
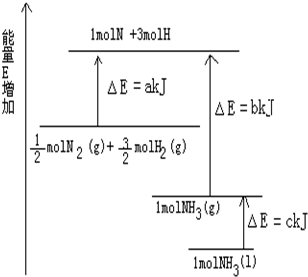 已知化学反应N2+3H2═2NH3的能量变化如图所示,
已知化学反应N2+3H2═2NH3的能量变化如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 伴随有能量变化的物质变化都是化学变化 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | 已知相同条件下2SO2(g)+O2(g)?2SO3(g)△H1,反应2SO2(s)+O2(g)?2SO3(g)△H2,则△H1>△H2 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓H2SO4与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15种 | B. | 12种 | C. | 10种 | D. | 9种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com