
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
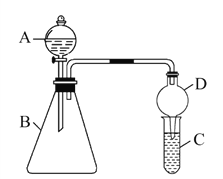
利用如图装置验证同主族元素非金属性的变化规律。
(1)干燥管D的作用为____。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察到C中溶液____的现象即可证明,写出C中反应的离子方程式_______________。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液____的现象,即可证明。但有同学认为该实验存在不足,请简要说明___________________________________。
【答案】 防倒吸 溶液变蓝色 Cl2+2I-=2Cl-+I2 生成白色胶状沉淀 HCl具有挥发性,应加除杂装置
【解析】(1)球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中; (2)KMnO4与浓盐酸常温下反应生成氯气,氯气能够将碘离子氧化成碘单质,碘单质遇到淀粉变成蓝色,反应的离子方程式为Cl2+2I-=2Cl-+I2;(3)盐酸和碳酸钙反应生成CO2,CO2通入硅酸钠溶液中产生硅酸沉淀,因此实验现象是C中生成白色胶状沉淀;氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和C之间增加装有饱和NaHCO3溶液的洗气瓶。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生如下反应:
A(s)+3B(g)![]() 2C(g)
2C(g)
若经3s后测得C的浓度为0.6molL-1,下列选项说法正确的组合是
①用A表示的反应速率为0.1molL-1s-1
②用B表示的反应速率为0.4molL-1s-1
③3s时生成C的物质的量为1.2 mol
④3s时B的浓度为0.6molL-1
A.①②④ B.①③④ C.③④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2) 3的说法正确的是
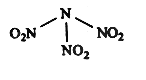
A.分子中N、O间形成的共价键是非极性键 B.分子中四个氮原子共平面
C.该物质既有氧化性又有还原性 D.15.2g该物质含有6.02×1022个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中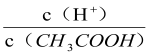 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不![]() 变
变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)在2 L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡(X、Y、Z均为气态)。

(1)该反应的化学方程式是 。
(2)反应起始至t时刻,Y的平均反应速率是 。
(3)关于该反应的说法正确的是 。
A.到达t时刻该反应已停止 |
B.在t时刻之前X的消耗速率大于它的生成速率 |
C.在t时刻正反应速率等于逆反应速率 |
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO的一种制备流程图如下:
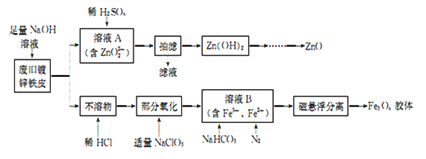
(1)用NaOH溶液处理废旧锌铁皮发生反应的化学方程式为____________。
(2)①若溶液A中滴加稀H2SO4过量,会溶解产生的Zn(OH)2,可改用的方法是____________。
②由Zn(OH)2灼烧制ZnO前需进行洗涤,检验沉淀洗涤是否干净的方法是______________。
(3)流程中加人NaC1O3发生反应的离子方程式为______________。
(4)①由溶液B制得Fe3O4胶体粒子的过程中通入N2的原因是____________。
②溶液B中主要发生的离子反应方程式为________________。
③确定溶液B中含有Fe2+的实验方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),这种元素的原子结构示意图为___________。
(2)④与⑤两种元素相比较,原子半径较大的是_______(填元素符号);在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是______(填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是_______(填化学式),具有两性的化合物是_______(填化学式)。
(3)③与⑥元素的氢化物的稳定性_________ 大于 __________(填化学式)。
(4)元素④和元素⑦形成化合物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
(5)⑦的氢化物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)若把长式元素周期表原先的主副族及族号取消,由左至右改为18列,如碱金属元素在第1列,稀有气体元素在第18列。按此规定,下列说法错误的是( )
A.第9列元素中没有非金属元素
B.只有第2列元素原子最外层有2个电子
C.第1列元素均为金属元素
D.在整个18列元素中,第3列的元素种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 在稀溶液中,1 mol酸和1 mol碱完全反应所放出的热量,叫做中和热
B. 在101 kPa时,1 mol物质燃烧时所放出的热量叫做该物质的燃烧热
C. 热化学方程式中,各物质前的化学计量数不表示分子个数
D. 如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com