
常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是( )
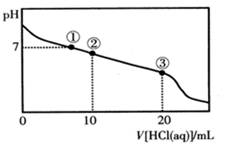
A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(Na+)>c(CH3COOH)>c (H+)>c(CH3COO-)
D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
为探究原电池的形成条件和反应原理,某同学设计了如下实验,并记录了实验现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述浓度的稀硫酸中插入铜片,没有气泡生成;
③将锌片与铜片上端接触并捏住,一起插入上述浓度的稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入上述浓度的稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,不正确的是 ( )。
A.实验①、②说明锌能与稀硫酸反应而铜不能
B.实验③说明发生原电池反应时会加快化学反应速率
C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气
D.实验③、④说明该原电池中铜为正极、锌为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
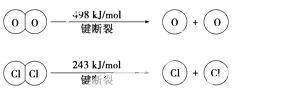
(1)已知:反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
①H2O的电子式是________。
②反应A的热化学方 程式是______________________
程式是______________________ ____________________________。
____________________________。
③断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为________ kJ, H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是( )
A. Na+ B.SO42- C. Ba2+ D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是( )
A.放出热量关系:a < b < 92.4 B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③ D.N2的转化率:②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式: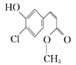 ,下列关于该有机物的叙述正确的是
,下列关于该有机物的叙述正确的是
A.该有机物的摩尔质量为200.5
B.该有机物属于芳香烃
C.该有机物可发生取代、加成、加聚、氧化、还原、消去反应
D.1 mol该有机物在适当条件下,最多可与4 mol NaOH、4 mol H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
I.用乙炔等合成烃C。

已知:

(1)A分子中的官能团名称是_______、_______。
(2)A的一种同分异构体属于乙酸酯,其结构简式是________________
(3)B转化为C的化学方程式是________________________________________,其反应类型是_______。
II.用烃C或苯合成PMLA的路线如下。

已知:

(4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8 L,H有顺反异构,其反式结构简式是________________
(5)E的结构简式是________________
(6)G与NaOH溶液在加热条件下反应的化学方程式是_________________________
(7)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种)________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
使用氯化钠作原料可以得到多种产品。
(1)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的物质的量浓度是______________(忽略反应前后溶液体积的变化)。
(2)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通 电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。对电源电极名称和消毒液的主要成分判断正确的是________。
电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。对电源电极名称和消毒液的主要成分判断正确的是________。
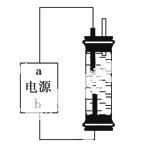
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
(3)实验室中很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。某同学利用上图装置,只更换一个电极,通过电解法制取较纯净的Fe(OH)2沉淀,且较长时间不变色。该同学换上的电解材料是__________(用元素符号表示),总的反应式是______________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com