
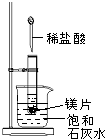
 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:分析 (1)Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;
(2)有电子转移的化学反应是氧化还原反应;
(3)单质、气体、沉淀等写化学式,可溶性强电解质写离子;
(4)放热反应中反应物总能量大于生成物总能量.
解答 解:(1)Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小,
镁和稀盐酸反应生成氯化镁和氢气,所以试管中镁片逐渐溶解,生成氢气,所以试管中产生无色气泡,金属和酸的反应是放热反应,氢氧化钙溶解度随着温度升高而减小,升高温度,氢氧化钙饱和溶液变为过饱和溶液,所以烧杯底部析出少量白色固体;故答案为:镁片逐渐溶解、管中产生无色气泡、管中产生无色气泡;
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体,故答案为:镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
(3)单质、气体、沉淀等写化学式,可溶性强电解质写离子,离子方程式为Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑;
(4)放热反应中反应物总能量大于生成物总能量,该反应是放热反应,所以MgCl2溶液和H2的总能量小于镁片和盐酸的总能量,即生成MgCl2和H2时形成化学键所释放的总能量大于消耗镁片和盐酸时断裂化学键所吸收的总能量,故答案为:大于.
点评 本题以镁、氢氧化钙为载体考查能量守恒、氧化还原反应、离子方程式的书写等知识点,明确实验原理是解本题关键,注意分析氢氧化钙溶液变化,题目难度不大.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式 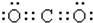 | |
| B. | Cl-的结构示意图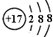 | |
| C. | NaOH的电子式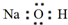 | |
| D. | 原子核内有20个中子的氯原子${\;}_{17}^{37}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性:PH3>CH4 | |
| B. | HCl的电子式为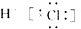 | |
| C. | D2O分子所有原子均达到最外层8e-稳定结构 | |
| D. | VIIA族元素中F的最高价氧化物对应水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | KCl | C. | CaCl2 | D. | AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
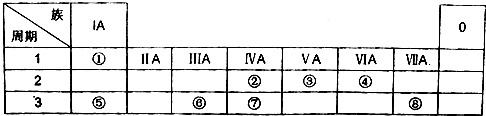
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com