
【题目】下列实验操作能达到实验目的是( )
实验目的 | 实验操作 | |
A | 配制1.0mol/L CuSO4溶液 | 把25g胆矾晶体溶于水配成100mL溶液 |
B | 证明某溶液中含有SO42﹣ | 向该溶液中滴入BaCl2溶液 |
C | 实验室制大量CO2 | 向稀硫酸中加入大理石 |
D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
A.A
B.B
C.C
D.D
【答案】A
【解析】A.25g胆矾晶体的物质的量为 ![]() =0.1mol,c=
=0.1mol,c= ![]() =1mol/L,则把25g胆矾晶体溶于水配成100mL溶液可配制1.0mol/L CuSO4溶液,故A符合题意;
=1mol/L,则把25g胆矾晶体溶于水配成100mL溶液可配制1.0mol/L CuSO4溶液,故A符合题意;
B.应先加盐酸排除干扰,再加氯化钡检验硫酸根离子,故B不符合题意;
C.生成硫酸钙微溶,阻止反应的发生,应选碳酸钙与盐酸制备二氧化碳,故C不符合题意;
D.饱和的FeCl3溶液滴加到热NaOH溶液中,生成沉淀,应饱和的FeCl3溶液滴加到沸水中制备胶体,故D不符合题意;
故答案为:A.
A.根据硫酸铜溶液的浓度和体积计算需要胆矾的质量;
B.检验硫酸根离子应先加盐酸排除干扰;
C.碳酸钙与硫酸反应生成硫酸钙微溶,阻止反应的发生;
D.饱和的FeCl3溶液滴加到热NaOH溶液中,生成沉淀.


科目:高中化学 来源: 题型:
【题目】废旧印刷电路板的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJmol﹣1
2H2O2(l)=2H2O(l)+O2(g)△H=﹣196.46kJmol﹣1
H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 .
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 .
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液与人类生活息息相关,请回答下列问题
(1)某温度下,Kw=1×10﹣12( molL﹣1)2 , 若保持温度不变,向水中滴入稀硫酸恰好使溶液中c(H+)/c(OH﹣)=1×1010 , 则此时水电离出的c(H+)=molL﹣1 .
(2)常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是 .
A.若混合后溶液呈中性,则c(H+)+c(OH﹣)=2×10﹣7mol/L
B.若V1=V2 , 混合后溶液的pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(3)下列曲线中,可以描述乙酸(甲,Ka=1.8×10﹣5 mol/L)和一氯乙酸(乙,Ka=1.4×10﹣3 mol/L)在水中的电离度与浓度关系的是 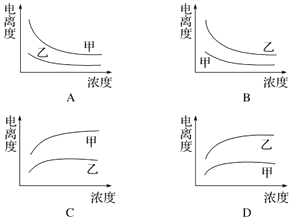
(4)在下列实验中,能证明醋酸酸性比盐酸酸性弱的是 .
A.将等体积、pH=4的盐酸和醋酸稀释成pH=5的溶液,测量所需加入水量的多少
B.向等体积、等pH的盐酸和醋酸中分别加入同量的相应钠盐固体,测溶液的pH有无变化
C.向等体积、等浓度的盐酸和醋酸分别加入足量锌粉,测量产生氢气的体积
D.用等体积、等浓度的盐酸和醋酸做导电性实验,根据灯泡的明亮程度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%浓硫酸配制2mol/L的稀硫酸,下列情况会使所配溶液浓度偏低的是( )
A.未冷却就转移、定容
B.容量瓶原有少量蒸馏水
C.定容时俯视刻度线观察液面
D.量筒取浓盐酸时,俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应C(s)+H2O(g)H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图. 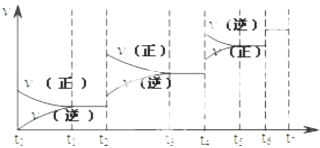
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是、;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的化学方程式书写及反应类型判断均正确的是( )
A.甲烷与氯气反应:CH4+Cl2 ![]() CH3Cl+HCl(加成反应)
CH3Cl+HCl(加成反应)
B.乙烯与水在一定条件下生成乙醇:CH2=CH2+H2O ![]() C3CH2OH(加成反应)
C3CH2OH(加成反应)
C.麦芽糖制葡萄糖: ![]() +H2O
+H2O ![]() (氧化反应)
(氧化反应)
D.乙醛与银氨溶液反应:CH3CHO+2Ag(NH3)2OH ![]() CH3COONH4+3NH3+2Ag↓+H2O(取代反应)
CH3COONH4+3NH3+2Ag↓+H2O(取代反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙.
【查阅资料】
Ⅰ.金属Ca的部分性质有:
①常温或加热条件下Ca都能与氧气反应;
②Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③Ca+H2 ![]() CaH2(固体)
CaH2(固体)
Ⅱ.固体CaH2的部分性质有:
①常温:CaH2+2H2O=Ca(OH)2+2H2↑; ②CaH2要密封保存.
【进行实验】
该小组同学设计的制取装置如图所示(固定装置略).
回答下列问题:
(1)写出Ca常温遇水发生反应的化学方程式: .
(2)B、D中所盛试剂相同,该试剂为(填名称);D中该试剂的作用是 .
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是: .
【实验反思】
该小组同学通过反思提出问题:上述制得的CaH2是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量为m g的CaH2样品,按图所示连接仪器(固定装置略).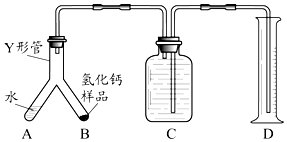
步骤2:将Y形管倾斜,使A中的水全部进入B中,样品全部反应后,冷却至室温,读取量筒读数为V mL.
(4)若该实验条件下的气体摩尔体积为Vm L/mol,当V=mL时(用m、Vm表示),表明制得的CaH2样品是纯净的.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼油厂常将裂解产生的其它烯烃加氢,对产物再次裂解以提高乙烯产量.相关加成反应如下: ① 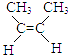 (g)+H2(g)CH3CH2CH2CH3(g)△H1
(g)+H2(g)CH3CH2CH2CH3(g)△H1
② 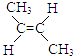 (g)+H2(g)CH3CH2CH2CH3(g)△H2
(g)+H2(g)CH3CH2CH2CH3(g)△H2
(1)已知反应①、反应②平衡常数k1、k2如下,下列叙述正确的是;
温度(℃) | 300 | 320 | 340 |
K1 | 4.8×10﹣4 | 2.5×10﹣4 | 1.3×10﹣4 |
K2 | 8.4×105 | 3.5×103 | 1.6×103 |
A.△H1>0;△H2<0
B.反应①、反应②都是丙烯加氢,所以△H1═△H2
C.相同条件下反应②的转化率大于反应①的转化率
D.从平衡常数推测,相同条件下反应②的反应速率很大,反应①的反应速率很小
(2)2﹣丁烯的顺、反异构转换过程的△H═(用△H1、△H2表示) 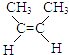 (g)→
(g)→ 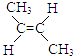 (g)△H
(g)△H
(3)在一定温度下,将等物质的量的反式2﹣丁烯和H2充入2L密闭容器中,发生反应②,容器内各物质浓度如图所示: 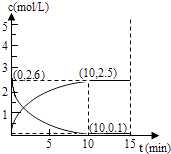
①前10分钟,平均反应速率v(H2)为molL﹣1min﹣1
②该温度下,此反应平衡常数K=(平衡常数不用写单位)
(4)已知表示H2和CH3CH2CH3标准燃烧热的热化学方程式为: H2(g)+ ![]() O2(g)→H2O(l)△H═﹣285.8kJmol﹣1
O2(g)→H2O(l)△H═﹣285.8kJmol﹣1
CH3CH2CH3(g)+5O2(g)→3CO2(g)+4H2O(l)△H═﹣2215kJmol﹣1
丁烯加成反应的热化学方程式为:
CH3CH=CH2(g)+H2(g)→CH3CH2CH3(g)△H═﹣125.4kJmol﹣1
则表示CH3CH=CH2标准燃烧热的热化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com