
【题目】丙烯酸是重要的有机合成原料及合成树脂单体,可通过以下方式制得:CH![]() CH
CH![]() CH2=CHCOOH,下列有关说法错误的是( )
CH2=CHCOOH,下列有关说法错误的是( )
A. CO分子的碳氧叁键中存在配位键
B. 丙烯酸分子中σ键与π键的个数比为4∶1
C. 乙炔和水均为极性分子
D. 丙烯酸具有酸性,且能发生加成反应、聚合反应和酯化反应
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是( )
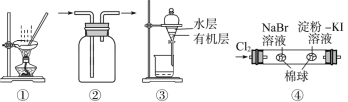
A. 用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 按装置②所示的气流方向可用于收集H2、NH3等
C. 用图③所示装置,分离CCl4萃取I2水后的有机层和水层
D. 用图④所示装置,可以证明氧化性:Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
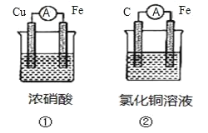
【题目】(1)为了验证 Fe2+与 Cu2+氧化性强弱,下列装置能达到实验目的的是_______(填装置序号), 其正极的电极反应式为_______;若构建该原电池时两个电极的质量相等,当导线中通过 0.4 mol 电子时,两个电极的质量差为_______g。
(2)将 CH4 设计成燃料电池,其利用率更高,装置如图所示(A、B 为多孔碳棒)。

实验测得 OH- 定向移向 A 电极,则_______(填 A 或 B)处电极入口通 CH4,其电极反应式为_______。
(3)金属冶炼和处理常涉及氧化还原反应。由下列物质冶炼相应金属时采用电解法的是_______(填选 项字母)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为Zn+2OH2e===Zn(OH)2,Ag2O+H2O+2e===2Ag+2OH。下列叙述中正确的是( )
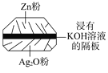
A. 在使用过程中,电解质KOH不断被消耗
B. 使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn电极发生还原反应,Ag2O电极发生氧化反应
D. Zn是负极,Ag2O是正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。如表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为7。下列说法错误的是( )
![]()
A. W单质的熔点一定高于Y单质
B. X 的离子半径在同周期元素简单离子半径中最小
C. 最高价氧化物水化物酸性:W>X
D. 简单气态氢化物热稳定性:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )
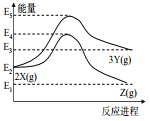
A.由 X→Z 反应的 ΔH<0 B.由 X→Y 反应的 ΔH=E5-E2
C.增大压强有利于提高 Y 的产率 D.升高温度有利于提高 Z 的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛镍合金被称为记忆合金,是一种具有独特形状记忆功能、耐磨损、抗腐蚀、超弹性等特点的功能材料,主用于航空航天、医疗等领域。回答下列问题:
(1)基态镍原子的价电子排布式为 __________,其所在周期第一电离能最小的元素名称为__。
(2)钛铁矿经过 H2SO4、HNO3等多种物质处理后会生成硫酸氧钛等中间产物。
①硫酸氧钛晶体中阳离子为如图1所示链状聚合形式的离子,该晶体的化学式为_,晶体中存在的微粒间作用力有离子键、___和____。

②查资料知H2SO4和HNO3的沸点分别为338℃和83℃,试分析差异大的主要原因__。
(3)镍是人体必需的微量元素,但超量中毒易过敏或诱发癌症。急性镍中毒通常用二乙基二硫代氨基钠(结构如图2)解毒,该物质中碳原子的杂化方式有___。

(4)Ni、O、Cr 可以形成一种具有特殊导电性的复合氧化物晶胞结构如图3。若晶胞参数为apm,晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为__pm。设阿伏加德罗常数数值为NA,则该晶体密度为__g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
I.将等物质的量的A、B混合放于2 L的密闭容器中,发生反应3A(g)+B(g)![]() xC(g)+2D(g)。经5 min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A)∶c(B)=3:5,v(C)=0.1 mol/(L·min)。则:
xC(g)+2D(g)。经5 min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A)∶c(B)=3:5,v(C)=0.1 mol/(L·min)。则:
(1)x=________。
(2)前5 min内B的反应速率v(B)=_________。
(3)平衡时A的转化率为_________。
II.水蒸气通过炙热的碳层发生反应:C(s)+H2O(g)![]() CO(g)+H2(g)△H。
CO(g)+H2(g)△H。
(4)已知:K(300℃)<K(350℃),则该反应是_________热反应。
(5)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(v正)随时间的变化如下图所示,填出对应的编号。

① 缩小容器体积_________;
② 降低温度 ____________;
(6)已知反应①CO(g)+CuO(g)![]() CO2(g)+Cu(s),②H2(g)+CuO(g)
CO2(g)+Cu(s),②H2(g)+CuO(g)![]() Cu(s)+H2O(g),在相同的某温度下的平衡常数分别为K1和K2,该温度下反应CO(g)+H2O(g)
Cu(s)+H2O(g),在相同的某温度下的平衡常数分别为K1和K2,该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=__________(用K1和K2表示)。
CO2(g)+H2(g)的平衡常数K=__________(用K1和K2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。

装置(Ⅰ)的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为2Na2S2+NaBr3化气![]() Na2S4+3NaBr。当闭合开关K时,X电极附近溶液变红。下列说法正确的是
Na2S4+3NaBr。当闭合开关K时,X电极附近溶液变红。下列说法正确的是
A. 闭合开关K时,钠离子从右到左通过离子交换膜
B. 闭合开关K时,负极反应式为:3NaBr-2e-=NaBr3+2Na+
C. 闭合开关K时,X电极反应式为:2Cl--2e-=Cl2↑
D. 闭合开关K时,当有0.1molNa+通过离子交换膜,X电极上析出标准状况下气体1.12L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com