
A.1∶1 B.1∶2
C.2∶1 D.2∶3
| 解析:这两种盐均由铁和硫酸根组成,只因铁的价态不同,导致两种盐中铁和硫酸根之比不同.但是,因为硫酸盐,阴离子相同,则两种盐中S和O原子个数比相同,均为1∶4.已知硫的质量分数,即可求得氧的质量分数,进而又求得铁的质量分数,列方程可求得两种盐的物质的量.设混合物中含有FeSO4 x mol,Fe2(SO4)3
y mol,总质量为A g.
因为n(S)∶n(O)=1∶4 所以m(S)∶m(O)=32∶(4×16)=1∶2 由S%=22.73%,则O%=2×22.73%=45.46%.Fe%=(100-22.73-45.46)%=31.81%.按S质量守恒:32x+32×3y=22.73%A,按Fe质量守恒:56x+56×2y=31.81%A,解方程得:x∶y=2∶ |


科目:高中化学 来源:英德中学2007届高三化学第二轮复习专题强化训练7 题型:058
钛被称为继铁、铝之后的第三金属,也有人说“21世纪将是钛的世纪”.
(1)二氧化钛在现代社会里有广泛的用途,它的产量是一个国家国民经济发展程度的标志.我国至今产量不足,尚需进口二氧化钛.“硫酸法”生产二氧化钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质),主要生产流程是:
①将钛铁矿与浓H2SO4煮解:FeTiO3+2H2SO4(浓)===TiOSO4+FeSO4+2H2O(硫酸钛酰)
②加水分解硫酸氧钛:TiOSO4+(n+1)H2O===TiO2·nH2O+H2SO4
③
煅烧TiO2·nH2O“硫酸法”生产TiO2排放的废液对水体有哪些污染,请指出主要的二点:
①________;
②________.
根据废液主要成分,针对其中一项污染,提出处理的方法.③________
(2)某化学兴趣小组对Mg、Ti、Cu三种金属的金属活动性顺序进行探究.
提出假设:a.Ti金属活动性比Mg强;b.Ti金属活动性比Cu弱.
查阅资料:在相同条件下,金属与酸反应产生气泡的速度快,则该金属活动性越强.
实验设计:同温下,取大小相同的这三种金属薄片,用砂布将表面擦光亮,分别投入等体积等浓度的足量稀盐酸和稀HF溶液中反应,观察现象.
①稀盐酸:放出H2速率Mg>Ti,铜不反应.②稀HF:放出H2速率Ti>Mg
根据上述________现象(填①或②)得出金属活动性Mg________Ti.如何解释另一反常现象________.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 常见非金属元素单质及其重要化合物练习卷(解析版) 题型:实验题
甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。
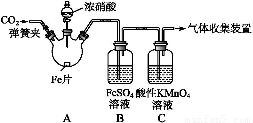
文献记载:Ⅰ.在浓硝酸与活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物。
Ⅱ.FeSO4+NO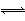 Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。
Ⅲ.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
实验操作 | 实验现象 |
打开弹簧夹,通入一段时间CO2,关闭弹簧夹。 |
|
打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余。 |
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是 。
(2)检验是否生成-3价氮的化合物,应进行的实验操作是 。
(3)甲取少量B中溶液,加热,实验现象是 。请用化学平衡原理解释原因: 。甲依据该现象得出的结论是A中有NO生成。
(4)乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是 ,证明有NO生成的实验现象是 。
(5)证明A溶液中含有Fe3+,选择的药品是(填序号) 。
A.铁粉?? B.溴水????? C.铁氰化钾溶液D.硫氰化钾溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 常见金属元素单质及其重要化合物练习卷(解析版) 题型:填空题
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是 。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 。
A.Mg2+B.Fe2+??????????????????? C.Al3+D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ的名称是 ,操作Ⅱ的名称是 。
②写出在空气中煅烧FeCO3的化学方程式 。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a.称取2.850 g绿矾(FeSO4·7H2O)产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液放入锥形瓶中;
c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计的下列滴定方式,最合理的是 。(夹持部分略去)(填字母序号)

③写出滴定过程中反应的离子方程式: 。
④计算上述样品中FeSO4·7H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省八校高三下学期联考理综化学试卷(解析版) 题型:实验题
绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究:
FeSO4?7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去
Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
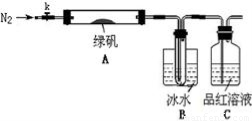
(二)探究绿矾(FeSO4·7H2O)热分解的产物
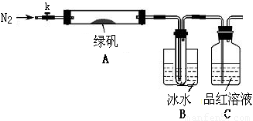 已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是?????????????????? ;
结论2:C中溶液褪色,可推知产物中有???? ?????????????? ;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足:??????????????????????????? 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是?????????? 。
a.氯水和KSCN溶液???? b.酸性KMnO4溶液????? c.H2O2???? d.NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com