
【题目】易形成简单阳离子的元素是( )
A. Cl B. Ne C. Na D. S
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】某有机物的分子式为C8H8 , 经研究表明该有机物不能发生加成反应和加聚反应.在常温下难于被酸性KMnO4溶液氧化.但在一定条件下却可与Cl2发生取代反应.而且其一氯代物只有一种.下列对该有机物结构的推断中一定正确的是( )
A.该有机物中含有碳碳双键
B.该有机物属于芳香烃
C.该有机物分子具有平面环状结构
D.该有机物具有三维空间的立体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。在硫酸的生产中,最关键的一步反应为2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
(1)一定条件下,SO2与O2反应10min后,若SO2和SO3的物质的量浓度分别为1mol/L和3mol/L,则SO2起始物质的量浓度为____________________;10min内生成SO3的平均反应速率v(SO3)为____。
(2)下列关于该反应的说法正确的是_________(填选项字母)。
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率
D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中,若某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是___________(填选项字母)。
A.O2为0.2mol/L B. SO2为0.25mol/L
C.SO3为0.4mol/L D. SO2、SO3均为0.15mol/L
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101KPa时:
2 SO2(g)+ O2(g)2SO3(g)△H1=-197kJmol-1;
H2O(g)═H2O(l)△H2=-44kJmol-1;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJmol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是____________________。
(5)工业制硫酸,用过量的氨水对SO2进行尾气处理,该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源,海水综合利用的流程图如图1: 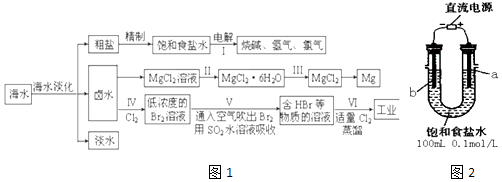
(一)某化学研究小组用图装置2模拟步骤I电解食盐水 (用铁和石墨做电极).
(1)a电极材料是(填铁、石墨),其电极反应式为 .
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为(忽略反应前后溶液体积的变化). (二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+ . 表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+ , 最适宜选用的物质是(填序号,下同),加入调节溶液的pH,充分反应后过滤,可得MgCl2溶液. a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2H2O获得MgCl2的操作是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生产硝酸、尿素等物质的重要原料。
(1)氨催化氧化法是工业制硝酸的主要方法。已知:
2NO(g)+3H2(g) ![]() 2NH3(g)+02(g) △H1=-272.9kJ/mol
2NH3(g)+02(g) △H1=-272.9kJ/mol
2H2(g)+02(g)![]() 2H2O(g) △H2=-483.6kJ/mol
2H2O(g) △H2=-483.6kJ/mol
则4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H3=__________
4NO(g)+6H2O(g) △H3=__________
(2)恒容密闭容器中进行合成知反应:N2(g)+3H2(g)![]() 2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
温度/K | 298 | 398 | 498 | … |
平衡常数(K) | 4.1×106 | K1 | K2 | … |
K1____K2(填“>”或“<”),其判断理由是_____________。
(3)向氨合成塔中充入10molN2和40molH2合成氨,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。

①下列说法正确的是______(填字母)。
A.由图1可知增大体系压强(p)有利于增大氨气在混合气体中的体积分数
B.若图1中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度的主要目的是提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
②当温度为T、氨气的体积分数为25%时,N2的转化率为__________。
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后得到溶液中溶质的质量分数为_______。
(5)氮碳比[![]() ]对合成尿素的反应:2NH3(g)+CO2(g)
]对合成尿素的反应:2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当
CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当![]() =_______时,尿素的产量最大,该条件下反应的平衡常数K=________。
=_______时,尿素的产量最大,该条件下反应的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国稀土资源丰富,下列有关稀土元素![]() Sm与
Sm与![]() Sm的说法正确的是( )
Sm的说法正确的是( )
A. 通过化学变化可实现![]() Sm与
Sm与![]() Sm的相互转化
Sm的相互转化
B. ![]() Sm与
Sm与![]() Sm的核外电子排布方式相同
Sm的核外电子排布方式相同
C. Sm元素的近似相对原子质量为150
D. ![]() Sm与
Sm与![]() Sm核外电子数和中子数均为62
Sm核外电子数和中子数均为62
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H (结构简式为 )是合成高分子化合物M的单体,H可以通过有机物A (分子式为C7H8O) 和丙酮为原料来进行合成,E为中间产物(结构简式为
)是合成高分子化合物M的单体,H可以通过有机物A (分子式为C7H8O) 和丙酮为原料来进行合成,E为中间产物(结构简式为 )其合成路线如图:
)其合成路线如图:

己知:![]()
请回答下列问题:
(1)A的名称为_________,G 中含氧官能团的名称是________________;①的反应类型是__________。
(2)检验有机物A中官能团的方法为______________________________。
(3)高分子化合物M 的结构简式为____________________。
(4)反应③的化学反应方程式为______________________________。
(5)有机物C有多种同分异构体,其中苯环上只有两个侧链的芳香酯的同分异构体有__________种
(6)已知: ,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() ,此合成路线为
,此合成路线为 ,请完成接下来的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上下注明试剂和反应条件)。____________
,请完成接下来的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上下注明试剂和反应条件)。____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com