
【题目】对氧化铝的分类中正确的是
A.酸性氧化物 B.碱性氧化物
C.两性氧化物 D.不成盐氧化物(像CO一样)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知0.3 mol·L-1酒精溶液的密度为ρ1 g·mL-1,0.1 mol·L-1酒精溶液的密度为ρ2 g·mL-1,其中ρ1<ρ2,若将上述两溶液等质量混合,(忽略混合时溶液体积的变化)所得酒精溶液的物质的量浓度是 ( )
A. 等于0.2 mol·L-1 B. 大于0.2 mol·L-1
C. 小于0.2 mol·L-1 D. 无法估算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4P(红磷s)![]() P4(白磷s) △H = +17kJmol﹣1根据以上方程式,下列推论正确的是
P4(白磷s) △H = +17kJmol﹣1根据以上方程式,下列推论正确的是
A. 正反应是一个放热反应
B. 当lmol白磷完全转变成红磷时放出17kJ热量
C. 当4g红磷转变成白磷时吸收17kJ热量
D. 白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在工农业上有重要作用。
(1)水煤气是将水蒸气通过灼热的焦炭而生成的气体,水煤气的主要成分为_________
(用化学式表示);
(2)高温时,用CO还原MgSO4可制备高纯度MgO。若在750℃时,测得气体中含有等物质的量的SO2、SO3,则反应的化学方程式为____________;
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由CO2制取碳的太阳能工艺如右图所示。

①若“重整系统”发生的反应中![]() =6,则FexOy的化学式为____________;
=6,则FexOy的化学式为____________;
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为____________。
(4)工业上用CO2和H2反应合成甲醚。
已知:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=130.8 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=130.8 kJ·mol-1
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是____________(填标号)。
a.逆反应速率先增大后减小 b.反应物的体积百分含量减小
c.H2的转化率增大 d.容器中的n(CO2)/n(H2)值变小
②某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。

T1温度下,将4molCO2和8molH2充入2L的密闭容器中,5min后该反应达到平衡,则0~5min内的平均反应速率v(CH3OCH3)=______________;
KA、KB、KC三者之间的大小关系为_____________。
(5)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在该溶液中,c(NH4+)________(填“>”、“<”或“=”)c(HCO3-;反应NH4++HCO3+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________。
NH3·H2O+H2CO3的平衡常数K=__________。
(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是
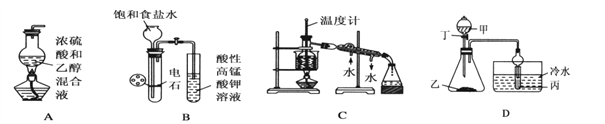
A. 实验室制乙烯
B. 实验室制乙炔并验证乙炔能发生氧化反应
C. 实验室中分馏石油
D. 若甲为硫酸,乙为贝壳(粉状),丙为苯酚钠溶液,验证硫酸、碳酸、苯酚酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.92gCu投入一定量的浓HNO3溶液中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下的气体672mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为( )
A. 504mL B. 224 mL C. 336 mL D. 168 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000 mol/L KOH溶液滴定20.00 mL 0.1000 mol/L CH3COOH溶液,滴定中pH变化如图,下列关系错误的是

A.V=0.00mL时,CH3COOH溶液pH=3,其电离平衡常数K≈10-5mol/L
B.V=10.00mL时,溶液中2c(K+)=c(CH3COO-)+c(CH3COOH)
C.V≥20.00mL时,溶液中一定有c(K+)>c(CH3COO-)>c(OH-)> c(H+)
D.溶液pH=7时,![]() =1
=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)制备铁红(Fe2O3)的生产流程如下:

试回答下列问题:
(1)步骤Ⅰ常需将烧渣粉碎、并加入过量H2SO4,其目的是 ;所得溶液中铁元素的化合价是 。
(2)步骤Ⅲ的目的是将溶液中的Fe3 +还原为Fe2 +,如何证明步骤Ⅲ已经进行完全 。步骤Ⅲ也可以加入FeS2代替铁粉的作用,请完成该反应的离子方程式:
FeS2 + 14Fe3 + + H2O=15Fe2 + + SO42- + 。
(3)步骤Ⅳ中可以选用试剂 调节溶液的pH(填字母编号)。
a.FeO固体 b.氢氧化钠溶液 c.Fe2O3固体 d.氨水
(4)步骤Ⅵ中发生反应的化学方程式为 。
(5)室温下FeCO3达到溶解平衡时溶液pH=8.5,c(Fe2+)=1.0×10-6 mol·L-1。通过计算说明FeCO3固体产物中是否含有Fe(OH)2 (已知:Ksp[Fe(OH)2]=4.8×10-16)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com