
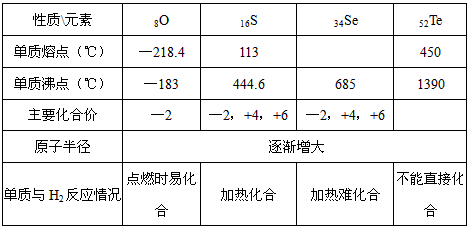
下表是氧族元素的相关性质
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | ―218.4 | 113 | 450 | |
| 单质沸点(℃) | ―183 | 444.6 | 685 | 1390 |
| 主要化合价 | ―2 | ―2,+4,+6 | ―2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是
(2)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生在化学反应方程式为 。
(3)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
□Al2Te3+□ ===Al(OH)3↓+□H2Te↑
(4)已知在常温下,H2和S反应生成17gH2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式: 。
(5)右图所示为氧族元素单质与H2反应过程中的
能量变化示意图,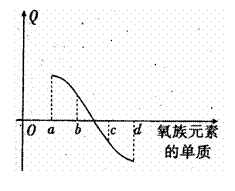 其中a、b、c、d分另表示
其中a、b、c、d分另表示
氧族中某一元素的单质,Q为相同物质的量
的单质与H2反应放出的热量。则:
a代表 ,c代表
(均可单质名称)
科目:高中化学 来源: 题型:阅读理解
| 元素代号 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期金属元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |

查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省衡水中学高二下学期期末考试化学试卷(带解析) 题型:填空题
(11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二下学期期末考试化学试卷(解析版) 题型:推断题
(11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
|
元素 |
相关信息 |
|
T |
T原子所处的周期数、族序数分别与其原子序数相等 |
|
X |
X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
|
Z |
Z的基态原子价电子排布为 |
|
Q |
在该元素所在周期中,Q的基态原子的第一电离能最小 |
|
R |
3p能级上有1个电子 |
|
W |
W的一种核素的质量数为65,中子数为36 |
(1)X、Y、Q三种元素的电负性由大到小的顺序是 (用元素符号表示)。
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要 (填“高”、“低”)。
(3)W2+的核外电子排布式为 。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1 molW参加反应有1 mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为 (填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g) 2R2Z3(s) △H=-2835.9 kJ/mol
4R(s)+2Z3(g) 2R2Z3(s) △H=-3119.1 kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H= .
查看答案和解析>>
科目:高中化学 来源:0120 模拟题 题型:填空题
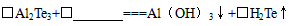

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com