
用NA表示阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4LCCl4含有的分子数为NA
B.常温常压下,17gNH3 所含的原子数目为4NA
C.1 mol Na2O2与H2O完全反应,转移2NA个电子
D.0.1mol/LNa2CO3溶液中含有的Na+数目为0.2NA
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
工业中硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别。线路①②③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。
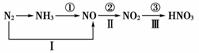
完成下列反应方程式:
写出①的化学方程式:____________________________________________________。
写出Ⅲ的化学方程式:____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
H2与O2发生反应的过程用模型图示如下(“﹣”表示化学键):下列说法不正确的是( )
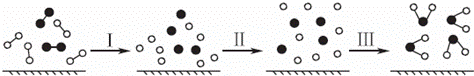
|
| A. | 过程Ⅰ是吸热过程 |
|
| B. | 过程Ⅲ一定是放热过程 |
|
| C. | 该反应过程所有旧化学键都断裂,且形成了新化学键 |
|
| D. | 该反应的能量转化形式只能以热能的形式进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷在氧气中燃烧的反应为:P4 + 5O2 == P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol—1、P—O b kJ·mol—1、P=O c kJ·mol—1、O=O d kJ·mol—1。
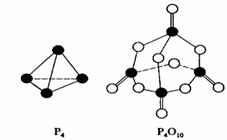
根据图示的分子结构和有关数据下列推断正确的是
A.6a+5d < 4c + 10b B.△H = (4c+12b-6a-5d) kJ·mol—1
C.6a+5d > 4c + 12b D.△H = (6a+5d-4c-12b) kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
1)已知Na2S2O3 + H2SO4 = Na2SO4 + S↓+ SO2 + H2O 。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
其他条件不变时:探究浓度对化学反应速率的影响,应选择____________。(填实验编号);
探究温度对化学反应速率的影响,应选择____________。(填实验编号)。
(2)甲同学设计如下实验流程探究Na2S2O3的化学性质。
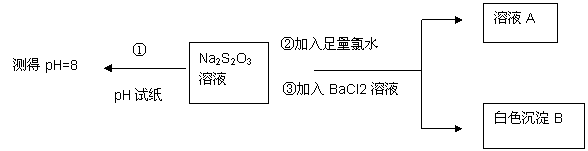
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和____________ 性。
(Ⅱ)生成白色沉淀B的离子方程式是 ____________。
(Ⅲ)已知Na2S2O3溶液与Cl2反应时, 1mol Na2S2O3转移8 mol电子。该反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为确定下列置于空气中的物质是否变质,所选检验试剂(括号内)不能达到目的的是( )
A.Na2SO3溶液(BaCl2溶液) B.FeSO4溶液(KSCN溶液)
C.漂白粉(稀硝酸) D.NaOH溶液[Ba(OH)2溶液]
查看答案和解析>>
科目:高中化学 来源: 题型:
蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于
过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是( )
A.沉淀X的成分是SiO2
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,得到的不溶物为Fe2O3
C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为:
3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是
A.放电时,正极区溶液的pH减小
B.放电时,负极反应式为3Zn-6e-+6OH-=3Zn(OH)2
C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原
D.充电时,电池的锌电极接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol/L、0.1 mol/L向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度是( )
A.0.15 mol/L B.0.225 mol/L
C.0.30mol/L D.0.45 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com