
| A、9 g |
| B、10 g |
| C、11 g |
| D、12 g |
科目:高中化学 来源: 题型:
| A、称量NaCl的质量 |
| B、用滴管滴加蒸馏水至刻度线 |
| C、量取蒸馏水的体积 |
| D、在烧杯中溶解NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化剂被还原,具有还原性 |
| B、氧化剂具有氧化性,是在反应中得到电子(或电子对偏向)的物质 |
| C、还原剂在反应时所含元素的化合价降低 |
| D、在一个反应中,氧化剂和还原剂不可能是同一物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
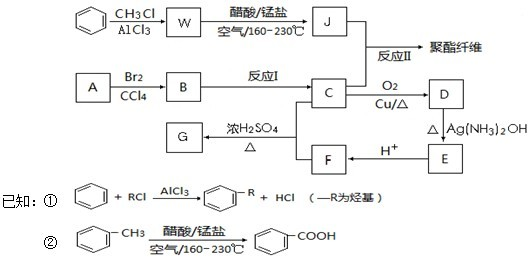
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀醋酸和稀氨水反应 |
| B、稀硫酸和烧碱溶液反应 |
| C、稀盐酸和氢氧化铜反应 |
| D、稀硫酸和氢氧化钡溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com