

| 实验 | 操作 | 现象 | |
| 实验Ⅰ (取褪色后溶液3等份) | 第1份 | 滴加FeCl2溶液 | 无明显变化 |
| 第2份 | 滴加KSCN溶液 | 溶液出现红色 | |
| 第3份 | 滴加稀盐酸和BaCl2溶液 | 产生白色沉淀 | |
| 实验Ⅱ (取与褪色后的溶液同浓度的FeCl3溶液) | 滴加2滴KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
分析 生产无水氯化铁流程:A装置:制取氯气,实验室常用浓盐酸与KMnO4(或KClO3)制取,制得的氯气中混有氯化氢和水蒸气,装置E:吸收HCl,装置C:作用是干燥氯气,常用浓硫酸,装置B:铁和氯气反应2Fe+3Cl2$\frac{\underline{\;加热\;}}{\;}$2FeCl3,冰水浴冷凝氯化铁并收集,氯气不能直接排放,用硫代硫酸钠在D装置中尾气吸收,S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,以此解答(1)~(4);
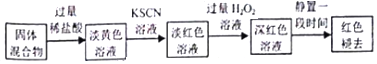
(5)将硬质玻璃管及收集器中的物质转移至锥形瓶中,加入过量的稀盐酸,得到淡黄色溶液,加入KSCN溶液,溶液淡红色,说明有铁离子,加入过量的过氧化氢溶液,溶液变深红色,说明铁离子浓度变大,即溶液中有亚铁离子,静置一段时间,红色退去;
对褪色溶液研究,实验I说明溶液中铁离子没有变化,有硫酸根离子生成,实验Ⅱ另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-,则该硫酸根离子由H2O2将SCN-氧化成SO42-.
解答 解:(1)根据仪器构造可知仪器N为分液漏斗;A装置用来制备氯气,从装置可知为固液不加热型制备氯气,选用浓盐酸与KMnO4(或KClO3)制取,
故答案为:分液漏斗;KMnO4(或KClO3);
(2)A装置制取氯气,制得的氯气中混有氯化氢和水蒸气,用饱和食盐水吸收氯化氢气体,所以a连接g连接h,在C装置中用浓硫酸吸收水蒸气,为吸收充分,导气管长进短出,则h连接d连接e,干燥纯净的氯气在B中与铁反应,则e连接b连接c,氯气不能直接排放,用硫代硫酸钠在D装置中尾气吸收,为防止D装置中的水蒸气进入氯化铁的收集装置,故尾气处理之前再接一个干燥装置;
故答案为:a,g,h,d,e,b,c;
(3)若缺少装置E,氯气中混有HCl,HCl和Fe反应生成的H2与Cl2混合受热发生爆炸,且有杂质氯化亚铁生成;检验是否有亚铁离子生成,可取少量产物于一洁净的试管种加少量水将产物溶解,向其中滴加铁氰化钾溶液,若产生蓝色沉淀,则证明存在氯化亚铁,
故答案为:HCl和Fe反应生成的H2与Cl2混合受热发生爆炸,且有杂质氯化亚铁生成;取少量产物于一洁净的试管种加少量水将产物溶解,向其中滴加铁氰化钾溶液,若产生蓝色沉淀,则证明存在氯化亚铁;
(4)装置D中,硫代硫酸钠(Na2S2O3)与氯气反应,Na2S2O3被氧化为Na2SO4,氯气被还原为氯离子,离子方程式为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(5)①加入KSCN溶液,溶液淡红色,说明有铁离子,加入过量的过氧化氢溶液,溶液变深红色,说明铁离子浓度变大,即溶液中有亚铁离子,过氧化氢将亚铁离子氧化为铁离子使铁离子浓度增大,离子方程式为:2Fe2++2H++H2O2=2F3++2H2O;
故答案为:2Fe2++2H++H2O2=2F3++2H2O;
②红色褪去的同时有气体生成,经检验气体为O2,说明有氧化还原反应的发生,实验I说明溶液中铁离子没有变化,有硫酸根离子生成,实验Ⅱ另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-,则该硫酸根离子由H2O2将SCN-氧化成SO42-;
故答案为:H2O2将SCN-氧化成SO42-.
点评 本题通过探究氯气与铁反应,考查了物质性质实验方案的设计方法,为高考常见题型和高频考点,题目难度中等,注意掌握氯气与铁反应的现象、反应原理,明确物质性质实验方案的设计原则,试题充分考查了学生的分析、理解能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 ,下列说法不正确的是( )
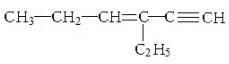
,下列说法不正确的是( )| A. | 1mol该烃完全燃烧消耗11mol O2 | |
| B. | 与氢气完全加成后的产物中含3个甲基 | |
| C. | 1mol该烃完全加成消耗Br2的物质的量为3mol | |
| D. | 该烃的核磁共振氢谱有12个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量低于生成物的总能量时,发生放热反应 | |
| B. | HCl和NaOH反应的中和热△H=-57.3KJ/mol,则H2SO4和Ba(OH)2的反应热△H=2×(-57.3)KJ/mol | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:戊<丁<丙 | |
| B. | 金属性:甲>丙 | |
| C. | 最高价氧化物水化物碱性:丙>丁>戊 | |
| D. | 最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,lmoI丙烷共用电子对数为10 NA | |
| B. | 0.5 moI甲烷和0.5 mol乙酸完全燃烧消耗的O2分子数都为0.2NA | |
| C. | 标准状况下,1L辛烷充分燃烧后生成气态产物的分子数为$\frac{8}{22.4}$NA | |
| D. | 1 mol甲醇与足量钠反应,转移电子数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
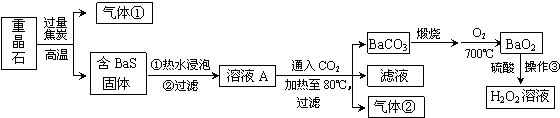
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com