
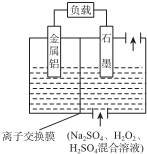
| A. | 铝作该电源的负极,电极反应为:Al-3e-═Al3+ | |
| B. | 电池总反应:2Al+3H2O2+6H+═2Al3++6H2O | |
| C. | 放电时溶液中的SO42-向正极移动 | |
| D. | 放电时正极周围溶液的pH升高 |
分析 原电池中,Al易失电子作负极,电极反应式为2Al-6e-=2Al3+,正极反应为6H++3H2O2+6e-=6H2O,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答 解:A.Al易失电子作负极,电极反应式为Al-3e-=Al3+,故A正确;
B.Al易失电子作负极,电极反应式为2Al-6e-=2Al3+,正极反应为6H++3H2O2+6e-=6H2O,总反应2Al+3H2O2+6H+═2Al3++6H2O,故B正确;
C.放电时,阴离子向负极移动,则电解质溶液在SO42--向负极移动,故C错误;
D.放电时,正极反应为2H++H2O2+2e-=2H2O,氢离子浓度降低导致溶液的pH升高,故D正确;
故选C.
点评 本题考查了化学电源新型电池,根据电池反应式正确书写电极反应式是解本题关键,再结合离子移动方向、电极反应式分析解答,题目难度不大,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 苯酚有一定毒性,不能作消毒剂和防腐剂 | |
| B. | 纤维素可水解成葡萄糖,人类可从中获得生存所需的能量 | |
| C. | 2014年1月,国家首次将雾霾天气纳入自然灾情进行通报,雾霾是一种不同于胶体的分散系,它的形成与大量焚烧田间秸秆有关 | |
| D. | 煤经气化和液化两个物理变化过程,可变为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 试剂如下: | 溶 液 温 度 | 中和热△H | ||||
| t1 | t2 | |||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | ||
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | ||
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
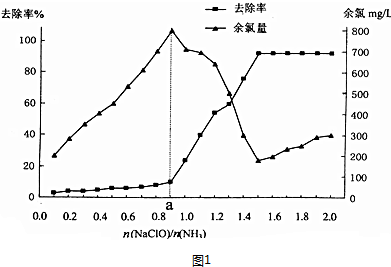
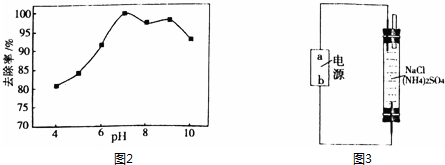
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力防治 PM2.5 的污染防治,可减少雾霾天气 | |
| B. | “84 消毒液”具有强氧化性,可作环境的消毒剂 | |
| C. | 发展低碳经济,利用太阳能、风能实现城市照明 | |
| D. | 可以用福尔马林溶液保存海鲜产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲苯苯环上的一个氢原子被含 4 个碳原子的烷基取代,所得产物有12种 | |
| B. | 等物质的量的氯气与乙烷在光照条件下反应得到10种产物 | |
| C. | 已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为6种 | |
| D. | 苯乙烯和氢气完全加成的产物的一溴取代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| D. | 屠呦呦获得了2015年诺贝尔奖,她用乙醚提取青蒿素的过程属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
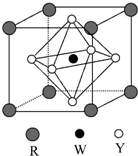 前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与氩原子相同;R原子的d轨道上有3个空轨道.请回答下列问题:
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与氩原子相同;R原子的d轨道上有3个空轨道.请回答下列问题: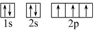 ,R基态原子的价层电子排布式为3d24s2.
,R基态原子的价层电子排布式为3d24s2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com