
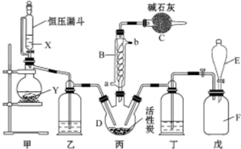
 图为实验室制溴苯的实验装置图,请根据图回答下列问题
图为实验室制溴苯的实验装置图,请根据图回答下列问题 .
.分析 (1)在溴化铁作催化剂条件下,溴和苯发生取代反应生成溴苯;
(2)溴和苯易挥发,导致生成的HBr中含有溴和苯,溴能和硝酸银反应生成淡黄色沉淀,对HBr检验造成干扰,但溴、苯易溶于四氯化碳;
(3)HBr和硝酸银发生复分解反应生成淡黄色沉淀;
(4)HBr极易溶于水,易产生倒吸现象;
(5)可溶性的物质易溶于水,所以用水洗涤易溶于水的物质;溴和氢氧化钠能反应所以可用氢氧化钠除去溴;干燥剂能吸收水分,利用物质沸点的不同可分离沸点不同的物质;
(6)根据双键能发生加成反应分析性质,根据Br-C-C-Br和Br-C=C-Br两种不同的位置分析结构.
(7)苯分子中含有一种特殊的化学键,键长介于C-C和C=C之间,不存在单纯的单、双键.
解答 解:(1)在溴化铁作催化剂条件下,溴和苯发生取代反应生成溴苯,反应方程式为 ,
,
故答案为: ;
;
(2)溴和苯易挥发,导致生成的HBr中含有溴和苯,溴能和硝酸银反应生成淡黄色沉淀,对HBr检验造成干扰,但溴、苯易溶于四氯化碳,所以双球U型管中盛放的试剂是CCl4,其作用是吸收溴蒸气,防止干扰HBr的检验,
故答案为:CCl4;吸收溴蒸气,防止干扰HBr的检验;
(3)HBr和硝酸银发生复分解反应生成淡黄色沉淀,所以看到的现象是有淡黄色沉淀生成,离子方程式为Ag++Br-=AgBr,
故答案为:有淡黄色沉淀生成;Ag++Br-=AgBr;
(4)HBr极易溶于水,如果将导气管伸入到试管中易产生倒吸现象,答:防止倒吸;
(5)该反应中,铁和溴能反应生成溴化铁,溴化铁作催化剂且易溶于水,所以混合物中含溴化铁;苯和溴不可能完全反应,混合物中含有溴和苯;制取溴苯的同时还有溴化氢生成,所以混合物的成分有:溴化铁、溴、苯、溴苯、溴化氢,
所以操作顺序如下:
第一步:HBr、溴化铁易溶于水而其它物质不易溶于水,所以先水洗洗去氢溴酸和溴化铁;
第二步:溴和氢氧化钠反应,所以用氢氧化钠洗去溴单质;
第三步:第二步洗涤会残留部分氢氧化钠,氢氧化钠能溶于水而其他物质不溶于水,所以用水洗去多余的氢氧化钠;
第四步:用水洗涤后会残留部分水分,所以用干燥剂除去多余的水;
第五步:两者沸点不同,苯的沸点小,被蒸馏出,溴苯留在母液中,所以采取蒸馏的方法分离溴苯与苯,
故选;
(6)1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,如果含有C=C键的话,则能发生加成反应而使溴水褪色,但真实的情况是苯不能使溴水应发生反应而褪色,这一点不能解释,再就是如果是单双建交替的正六边形平面结构,则邻二溴苯应有Br-C-C-Br和Br-C=C-Br两种不同的结构,但事实是邻二溴苯只有一种,这一点也不能解释,
故答案为:ad;
(7)苯分子中含有一种特殊的化学键,键长介于C-C和C=C之间,不存在单纯的单、双键,是介于碳碳单键和碳碳双键之间的特殊的键.
故答案为:介于碳碳单键和碳碳双键之间的特殊的键.
点评 本题以溴苯制取为载体考查物质制备,侧重考查物质分离提纯、物质制备、物质检验等知识点,明确实验原理及物质性质是解本题关键,注意物质检验时要排除其它物质的干扰,注意(5)操作先后顺序,题目难度不大.


科目:高中化学 来源: 题型:填空题
 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
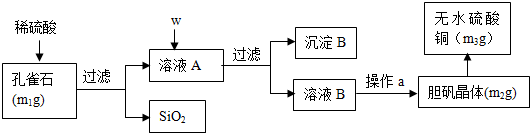
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
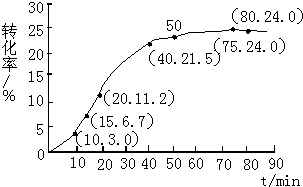 甲酸甲酯水解反应方程式为:
甲酸甲酯水解反应方程式为:| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol•min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
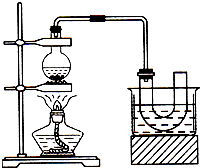 实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):
实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
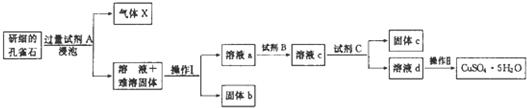
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.
磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com