
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | CaCl2═Ca2++2Cl- | B. | NH3•H2O?NH4++OH- | ||
| C. | CH3COOH═CH3COO-+H+ | D. | H2SO4═2H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热的反应一定是吸热反应 | |
| B. | 不需要加热的反应一定是放热反应 | |
| C. | 停止加热,反应就停止,该反应一定是吸热反应 | |
| D. | 放热反应都会发光并产生火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
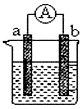 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯都既能发生加成反应,也能被酸性高锰酸钾溶液氧化 | |
| B. | 塑料、合成橡胶和合成纤维都属于有机合成高分子化合物 | |
| C. | 淀粉、纤维素、油脂和蛋白质在一定条件下都能发生水解反应 | |
| D. | C4H2Cl8有9种同分异构体(不含立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 5 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | HCl溶液 | C. | CuSO4溶液 | D. | NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
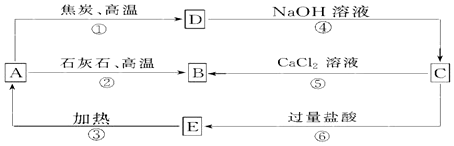
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不再改变 | B. | 水的消耗速率等于氢气的生成速率 | ||
| C. | 气体的密度不再改变 | D. | 反应不再进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com