
| A. | NO | B. | NO2 | C. | N2O3 | D. | NH4NO3 |
分析 生成二价金属硝酸盐时HNO3未被还原,参加反应的二价金属与消耗的硝酸的物质的量之比为2:5时,设物质的量分别为2mol、5mol,结合原子守恒和电子守恒来计算.
解答 解:生成二价金属硝酸盐时HNO3未被还原,参加反应的二价金属与消耗的硝酸的物质的量之比为2:5时,设物质的量分别为2mol、5mol,则二价金属硝酸盐时未被还原HNO3的物质的量为4mol,
设硝酸的还原产物中N元素的化合价为n,若被还原的硝酸的物质的量为5mol-4mol=1mol,
由电子守恒可知,2mol×(2-0)=1mol×(5-n),解得n=+1,NH4NO3中氮的平均化合价为+1,故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中电子守恒和原子守恒的应用为解答的关键,侧重分析与计算能力的考查,选项D易漏选,题目难度中等.


科目:高中化学 来源: 题型:解答题
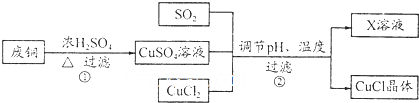
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率(%) | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键、极性键、非极性键 | B. | 氢键、氢键、极性键 | ||
| C. | 氢键、氢键、非极性键 | D. | 氢键、非极性键、极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力推广使用太阳能、风能等清洁能源,能减少PM2.5的污染 | |
| B. | 将燃煤通过气化和液化等物理变化可以减少污染,提高燃烧效率 | |
| C. | 发酵粉中含有较多的NaHCO3,能使焙制出的糕点疏松多孔 | |
| D. | 金属钠、镁等活泼金属着火时,不能使用泡沫灭火器来灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3=2Al3++3SO42- | B. | Na2CO3=Na++CO32- | ||
| C. | Ba(OH)2=Ba2++2 OH- | D. | NaHSO4=Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | =393.28 kJ | B. | =196.64 kJ | C. | <196.64 kJ | D. | >196.64 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+,Cl-,CO32-,Na+ | B. | H+,Ba2+,Fe3+,S2- | ||
| C. | NH4+,SO42-,K+,OH- | D. | H+,NO3-,Na+,SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
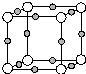 X、Y、Z、Q、W、N核电荷数依次增大的六种元素中,Y原子核外的L层电子数是K层的两倍,Q原子核外的L层中只有两个未成对电子,X与Y、Q可以以原子个数2:1或1:1形成化合物.W与Q同主族,元素N的第三能层共有5对成对电子.请回答下列问题:
X、Y、Z、Q、W、N核电荷数依次增大的六种元素中,Y原子核外的L层电子数是K层的两倍,Q原子核外的L层中只有两个未成对电子,X与Y、Q可以以原子个数2:1或1:1形成化合物.W与Q同主族,元素N的第三能层共有5对成对电子.请回答下列问题: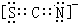 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com