
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图,判断下列叙述中正确的是
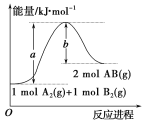
A.该反应的活化能是b kJ/mol
B.该反应热ΔH=+(a-b)kJ/mol
C.该反应中反应物的总能量高于生成物的总能量
D.1molA2(g)和1molB2(g)的能量总和是akJ
科目:高中化学 来源: 题型:
【题目】以煤、天然气和生物质为原料制取有机化合物日益受到重视。E是两种含有碳碳双键的酯的混合物。相关物质的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):

请回答:
(1) A→B的反应类型________,C中含氧官能团的名称________。
(2) C与D反应得到E的化学方程式________。
(3) 检验B中官能团的实验方法________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl36H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl36H2O。下列实验原理和装置不能达到实验目的的是( )

A.用装置甲制备NH3B.用装置乙制备Cu(NH3)4Cl2并沉铁
C.用装置丙分离Cu(NH3)4Cl2溶液和Fe(OH)3D.用装置丁将FeCl3溶液蒸干制备FeCl36H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为CO2与CH4转化为CH3COOH的反应历程(中间体的能量关系如虚框中曲线所示),图2为室温下某溶液中CH3COOH和CH3COO-两种微粒浓度随pH变化的曲线。下列结论错误的是

A. CH4分子在催化剂表面会断开C—H键,断键会吸收能量
B. 中间体①的能量大于中间体②的能量
C. 室温下,CH3COOH的电离常数Ka=10-4.76
D. 升高温度,图2中两条曲线交点会向pH增大方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取聚合硫酸铁(PFS)的化学方程式如下
2FeSO4+H2O2+(1-n/2)H2SO4=Fe2(OH)n(SO4)(3-n/2)+(2-n)H2O,
下图是以回收废铁屑为原料制备PFS的一种工艺流程。
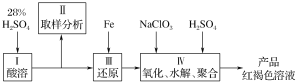
回答下列问题
(1)下列操作或描述正确的是________。
A.粉碎的目的是增大反应物接触面积,提高酸浸反应速率
B.酸浸中可以用硫酸、硝酸、盐酸等
C.反应釜中加入氧化剂,使Fe2+转化为Fe3+
D.减压蒸发的优点是降低蒸发温度,防止产物分解
(2)废铁屑使用前往往用________浸泡。
(3)废铁屑与酸发生多步反应,完成其中的化合反应的离子方程式______________________。
(4)聚合釜中溶液的pH必须控制在一定的范围内,目的是______________________。
(5)为了防止产物分解,必须采用减压蒸发,下列操作正确的是________。
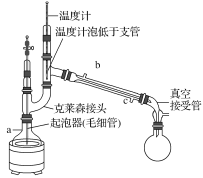
A.a为蒸馏烧瓶,b为冷凝管,c接自来水龙头
B.毛细管的作用和沸石相似,防止暴沸
C.随着温度计水银球高度提升,所得的气体的沸点升高
D.实验结束,先关闭冷凝管,再关闭真空泵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如下装置用于制取SO2并验证SO2的部分性质。
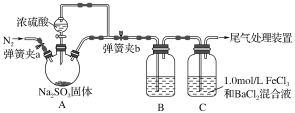
请回答下列问题:
(1)写出氮气的电子式________。
(2)B中选用不同的试剂可验证SO2不同的性质。为验证SO2具有酸性氧化物性质,在B中可以放入的试剂是________(填相应的编号)。
①新制氯水 ②品红溶液 ③含酚酞的NaOH试液 ④紫色石蕊试液
(3)装置C中可观察到白色沉淀现象,相关反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2L的恒容密闭容器中按不同方式投入反应物,发生反应:2CO(g) + 4H2(g)CH3OCH3(g) + H2O(g) △H<0,测得反应的相关数据如下表:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 600 | 600 | 500 |
反应物投入量 | 0.2mol CO 0.4mol H2 | 0.4mol CO 0.8mol H2 | 0.2mol CH3OCH3 0.2mol H2O |
平衡v(CO)/(mol·L-1·s-1) | v1 | v2 | v3 |
平衡n(H2)/(mol) | 0.2 | n2 | n3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | a1(CO) | a2(CO) | a3(CH3OCH3) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A.v1<v2,n2>0.4B.K2=2.5×103,p2>p3
C.2p1<p3,a1(CO) >a2(CO)D.n3<0.4,a2(CO) + a3(CH3OCH3)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S是重要的非金属元素,按要求回答下列问题:
![]() 烟道气中含有的CO和
烟道气中含有的CO和![]() 是重要的污染物,可在催化剂作用下将它们转化为
是重要的污染物,可在催化剂作用下将它们转化为![]() 和
和![]() ,此反应的热化学方程式为______。
,此反应的热化学方程式为______。
已知:![]() ;
;
![]()
![]() 向甲、乙两个均为lL的密闭容器中,分别充入
向甲、乙两个均为lL的密闭容器中,分别充入![]() 和
和![]() ,发生反应:
,发生反应:![]()
![]() 甲容器在温度为T1的条件下反应,达到平衡时
甲容器在温度为T1的条件下反应,达到平衡时![]() 的物质的量为牛
的物质的量为牛![]() ;乙容器在温度为T2的条件下反应,达到平衡时
;乙容器在温度为T2的条件下反应,达到平衡时![]() 的物质的量为
的物质的量为![]() 。则
。则![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ,甲容器中反应的平衡常数
,甲容器中反应的平衡常数![]() ______
______
![]() 如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭
如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭![]() ,分别将
,分别将![]() 和
和![]() 通过
通过![]() 、
、 充入A、B中,发生的反应为
充入A、B中,发生的反应为![]() ,起始时A、B的体积相同均为
,起始时A、B的体积相同均为![]() 。
。

![]() 图中正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是______。
图中正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是______。
a. 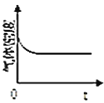 b.
b. 
c.  d.
d. 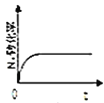
![]() 容器A中反应到达平衡时所需时间
容器A中反应到达平衡时所需时间![]() ,达到平衡后容器的压强变为原来的
,达到平衡后容器的压强变为原来的![]() ,则平均反应速率
,则平均反应速率![]() ______。
______。![]() 用a、t的代数式表示
用a、t的代数式表示![]()
![]() 达到平衡后,
达到平衡后,![]() 的体积分数:甲容器______乙容器
的体积分数:甲容器______乙容器![]() 填“
填“![]() ”、“
”、“![]() ”或”一
”或”一![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
B.放电时,Li+透过固体电解质向Cu极移动
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com