
| A. | 将SO2通入品红溶液中 | B. | 将Cl2通入KI溶液中 | ||
| C. | 将SO2通入溴水中 | D. | 将H2S通入硝酸溶液中 |
分析 反应中溶液中的H+浓度显著增大,说明二者反应时生成物中能电离出大量氢离子,据此分析解答.
解答 解:A.SO2能和有色物质品红溶液反应生成无色物质而体现漂白性,溶液中氢离子浓度变化不明显,故A不选;
B.该反应方程式为Cl2+2KI=I2+2KCl,溶液仍然呈中性,氢离子浓度变化不大,故B不选;
C.发生的反应为SO2+2Br2+2H2O=2HBr+H2SO4,溶液由强酸生成,导致溶液中氢离子浓度显著增大,故C选;
D.发生的反应为3H2S+2HNO3=2NO+4H2O+3S,溶液中氢离子浓度减小,故D不选;
故选C.
点评 本题考查元素化合物性质,为高频考点,明确物质之间反应及物质性质是解本题关键,注意CD中发生的反应,为易错点.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:填空题
| 实 验 操 作 | 答案 | 实验现象 |
| (1)向鸡蛋清中滴加少许浓硝酸,微热 | B | A.紫色褪去 B.变黄色 C.出现蓝色 D.溶液分层,下层呈紫红色 |
| (2)将乙烯通入少量酸性KMnO4溶液中 | A | |
| (3)将CCl4滴入盛有碘水的试管中,充分振荡,静止 | D | |
| (4)向土豆片上滴加碘水 | C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量(g/mol)与NA个硫酸分子的质量(g)在数值上相等 | |
| B. | NA个氧气分子和NA个氮气分子的质量比为8:7 | |
| C. | 1mol•L-1 CaCl2溶液中所含Ca2+离子的数目为NA | |
| D. | 1mol D2(重氢分子)中含有2NA个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.| 实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| T/℃ | 50 | 60 | 70 | 80 | 90 | |||
| c/mol•L-1 | 1.0 | 3.0 | 4.0 | 5.0 | 6.0 |
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在反应液中加入足量的稀盐酸 | 若溶液变浑浊且没有气体溢出(或:若没有气体溢出),则假设一成立;若溶液中有气体逸出,则假设一不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
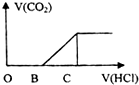 向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )
向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )| A. | 若OB=0,则溶液M为Na2CO3溶液 | |
| B. | 若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2═HCO3- | |
| C. | 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3) | |
| D. | 若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C与 12C互称同位素;O2与O3是氧元素的同素异形体 | |
| B. | 钢铁生锈主要发生吸氧腐蚀,镀锌铁皮镀层破损后对铁失去保护作用 | |
| C. | 石油的分馏、煤的干馏、电解质溶液导电均属于物理变化 | |
| D. | SO2和NO2属于酸性氧化物,Na2O和Fe3O4属于碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E | F | G | H | I | J | K |
| 常见化合价 | -1 | -2 | +5、-3 | +4、-4 | +6、+4、-2 | +4、-4 | +5、-3 | +3 | +2 | +1 | +1 |
| 原子半径/pm | 71 | 74 | 75 | 77 | 102 | 117 | 110 | 143 | 160 | 186 | 152 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com