
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
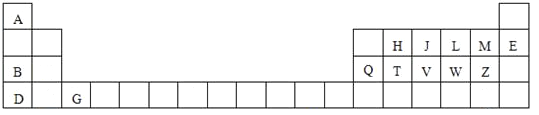
(1)原子半径最大的元素是 _____;在化合物中只有负价的元素是 ______;属于副族元素是____;适合作半导体材料的是____,(只用表中的字母填写)
(2)V在周期表中的位置第____周期第______族.
(3)A与M元素形成的化合物是______化合物,D与Z原子形成的化学键是____键;
(4)J、H、T三种元素的最高价含氧酸的酸性由强到弱的顺序是___________________________________;(用化学式表示)
(5)L元素形成的氢化物的在-4℃时是__________晶体(填晶体类型),其密度比对应的液态还小,呈固体而非气体的原因是____________________________________。
(6)写出B、Q两种元素的氧化物对应的水化物相互反应的化学方程式_________________________________________________________________。
【答案】 D M G T 三 VA 共价 离子 HNO3>H2CO3>H2SiO3(或H4SiO4) 分子 分子之间还能产生氢键 NaOH+Al(OH)3= NaAlO2+2H2O
【解析】本题分析:本题主要考查元素的性质。根据元素在周期表中的分布,可以确定A是氢,B是钠,D是钾,G是钪,H是碳,J是氮,L是氧,M是氟,E是氖,Q是铝,T是硅,V是磷,W是硫,Z是氯。
(1)原子半径最大的元素是左下角的D(K);在化合物中只有负价的元素是右上角的M(F);属于副族元素的是中间的G(Sc);适合作半导体材料的是T(Si)。
(2)从上述表中可以看出V在周期表中的位置是第三周期第VA族。
(3)H、F都是非金属元素,A与M元素形成的化合物是共价化合物,钾是活泼金属,Cl是活泼非金属,D与Z原子形成的化学键是离子键。
(4)非金属性J>H>T,J、H、T三种元素的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3(或H4SiO4)。
(5)L元素形成的氢化物水在-4℃时形成冰,冰是分子晶体,其密度比对应的液态水还小,呈固体而非气体的原因是水分子之间产生氢键。
(6)B、Q两种元素的氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3= NaAlO2+2H2O。


科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g) ΔH =-515kJ/mol
①C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) ΔH =-353kJ/mol
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大

(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为,理由是_______________。进料氨、空气、丙烯的理论体积约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子结构、元素性质的说法正确的是( )
A.非金属元素组成的化合物中只含共价键
B.ⅠA族金属元素是同周期中金属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为 283 kJ
B.反应①正反应活化能与逆反应活化能之差为+566 kJ/mol
C.反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-的物质的量最多的是( )
A.200mL 2mol/L MgCl2溶液
B.150mL 5mol/L KClO3溶液
C.标准状况下,13.44L的HCl气体
D.29.25gNaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下如图。E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同。

由此推知:
A________,B________,C________,D________,E________(填元素名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列3组物质均有一种物质的类别与其他三种不同
A.SO2、Na2O、CO2、SO3
B.烧碱、熟石灰、纯碱、苛性钾
C.HClO、H2SO4、H2CO3、NH3·H2O
以上A、B两组物质中类别不同的物质依次是(填化学式)
A: __________ ,B: __________;
若C组物质中类别不同的物质是H2SO4,则原因是H2SO4属于________________(填物质的类别)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“环境保护”意识深入人心,下列关于酸雨的认识中错误的是
A..正常条件下,pH值小于5.6的降雨是“酸雨”
B.冰岛火山喷发含有大量SO2,在局部区域形成酸雨
C.全球“低碳”行动能减少CO2排放量,也就能降低酸雨的形成及危害
D.汽车尾气含有氮氧化合物,过量排放形成酸雨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com