
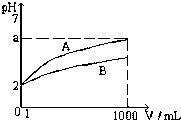
 T℃时,pH=2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示
T℃时,pH=2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示分析 (1)弱酸存在电离平衡,强酸完全电离,稀释过程中强酸的pH变化较大,据此进行分析计算;
(2)对上述硫酸再稀释10000倍后,氢离子浓度约为1.0×10-7mol/L,根据稀释过程中硫酸根离子的物质的量不变计算出硫酸根离子的浓度;
(3)反应CH3COO-+H2O?CH3COOH+OH-的平衡常数K=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{w}}{{K}_{a}}$,据此进行计算;
(4)分别根据n=cV计算出硫酸中氢离子、氢氧化钠溶液中的氢氧根离子的物质的量,然后判断溶液酸碱性,再计算出混合液中氢离子浓度,最后计算出混合液的pH.
解答 解:(1)T℃时,pH=2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000mL,醋酸在溶液中部分电离,稀释过程中电离程度增大,则稀释到1000mL时醋酸的pH<5,而硫酸为强酸,稀释后溶液中氢离子浓度为1.0×10-5mol/L,溶液的pH=5,即a=5,
故答案为:5;
(2)若对上述硫酸再稀释10000倍,由于溶液中存在水的电离平衡,则氢离子浓度约为1.0×10-7mol/L;而硫酸根离子浓度为:$\frac{\frac{1}{2}×1{0}^{-5}mol/L}{10000}$=5.0×10-10mol/L,则溶液中n(H+):n(SO42-)=1.0×10-7mol/L:5.0×10-10mol/L=200:1,
故答案为:200:1;
(3)在T℃时,醋酸的电离平衡常数K=1.0×10-5,Kw=1.0×10-13,泽尔反应CH3COO-+H2O?CH3COOH+OH-的平衡常数K=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{1×1{0}^{-13}}{1×1{0}^{-5}}$=1.0×10-8,
故答案为:1.0×10-8;
(4)在T℃时,取原硫酸溶液0.5Vml稀释到2VmL,稀释过程中氢离子的物质的量不变,pH=2的硫酸中氢离子浓度为0.01mol/L,则含有氢离子的物质的量为:0.01mol/L×5×10-4V=5×10-6Vmol,
0.1mol/L的NaOH溶液0.15Vml混合后稀释至10Vml,稀释后的溶液中含有氢氧根离子的物质的量为:0.1mol/L×1.5×10-4V=1.5×10-5Vmol,
混合液中氢氧根离子过量,溶液呈碱性,
则混合液中氢氧根离子浓度为:$\frac{1.5×1{0}^{-5}Vmol-5×1{0}^{-6}Vmol}{0.01VL}$=1.0×10-3mol/L,
该混合液中氢离子浓度为:$\frac{1×1{0}^{-14}}{1×1{0}^{-3}}$mol/L=1.0×10-10mol/L,
所以混合液的pH=10,
故答案为:10.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH得到关系为解答关键,注意掌握平衡常数的概念及计算方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.0 g乙烷中含有的碳氢键数为0.6NA | |
| B. | 标准状况下,22.4 L C2H5OH中含有的氢原子数为6 NA | |
| C. | 常温常压下,92 g的 NO2和N2O4混合气体含有的分子数为 6 NA | |
| D. | 标准状况下,由Na2O2制得11.2 L O2,反应转移的电子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2溶液与Fe的反应:Cu2++Fe═Fe3++Cu | |
| B. | 向硫酸氢钠溶液中加入少量氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 向碳酸钙固体中加入稀盐酸:CO32-+2 H+═CO2↑+H2O | |
| D. | 向碳酸钠溶液中加入澄清的石灰水:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾处理水时,高铁酸钾发生还原反应 | |
| B. | 湿法中每生成1mol Na2FeO4共转移3mol电子 | |
| C. | 干法中每生成1mol Na2FeO4共转移4mol电子 | |
| D. | K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C与“金施尔康”都是氧化剂 | |
| B. | 维生素C与“金施尔康”都是还原剂 | |
| C. | 维生素C是氧化剂,“金施尔康”是还原剂 | |
| D. | 维生素C是还原剂,“金施尔康”是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
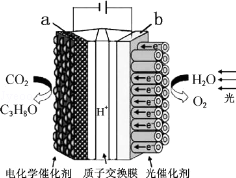 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成3mol O2,有88gCO2被还原 | |
| D. | a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 稀释浓硫酸时,应将浓硫酸倒入水中,边加边搅拌 | |
| C. | 用蒸发方法使NaCl从溶液里析出,应将蒸发皿中NaCl溶液全部蒸干才停止加热 | |
| D. | 分液操作中,分液漏斗中下层液体从下口放出,上层液体也从下口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B的平衡浓度之比为5:3 | B. | A和B的平衡浓度之比为2:3 | ||
| C. | x=1 | D. | x:y=2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com