
����10�֣�������ѧ֪ʶ������ش��������⣺
��1������8�����ӣ�10�����ӵ�ԭ�ӵĻ�ѧ����__________��
��2�����������Ų�Ϊ4s24p1��ԭ�ӵĺ˵����Ϊ__________��
��3��ijԪ�ر���ѧ�ҳ�֮Ϊ������Ԫ���еġ�����֮��������ԭ�ӵ���Χ�����Ų���4s24p4����Ԫ�ص�������_________��
��4������VSEPRģ�ͣ�H3O+�ķ�������ṹΪ�� ��SO2������ṹΪ�� ��
��5�����ڱ�������õķǽ���Ԫ��ԭ�ӵĹ����ʾʽΪ__________ ��
��6����ÿ��2�֣����Ȼ���������Ϊ���壬�۵�282��C���е�315�㣬��300��C������������������ˮ��Ҳ���������ѡ���ͪ���л��ܼ����ݴ��ж����Ȼ�������Ϊ________��
��7����ÿ��2�֣�ijԪ�غ������������Ӳ㣬�����������Ǻ������������1/6��д����Ԫ��ԭ�ӵĵ����Ų�ʽ��__________��
��1��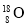 ��2��31 ��3����
��2��31 ��3����
��4�������� V��
��5��
���� | ���� | ���� | ���� | �� |
��6�����Ӿ��� ��7��1s22s22p63s2
��������
�����������1����ԭ�ӵ�������=������+������=8+10=18������8�����ӵ�Ԫ��ΪO����ԭ�ӵĻ�ѧ����Ϊ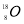 ����2�����������Ų�Ϊ4s24p1��ԭ�������ڲ���Ӳ�����ȫ�������ӣ����Ը�ԭ���е�����=2+8+18+3=31��ԭ���к��������=�˵�������������ĺ˵����Ϊ 31����3��ԭ�ӵ���Χ�����Ų���4s24p4��˵����ԭ���и���������������ӣ���ԭ�Ӻ����������34����������Ԫ�أ���4������VSEPRģ�͵ã�H3O+�ļ۲���Ӷ�=3+
����2�����������Ų�Ϊ4s24p1��ԭ�������ڲ���Ӳ�����ȫ�������ӣ����Ը�ԭ���е�����=2+8+18+3=31��ԭ���к��������=�˵�������������ĺ˵����Ϊ 31����3��ԭ�ӵ���Χ�����Ų���4s24p4��˵����ԭ���и���������������ӣ���ԭ�Ӻ����������34����������Ԫ�أ���4������VSEPRģ�͵ã�H3O+�ļ۲���Ӷ�=3+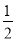 ��6-1-3��1��=4����1���µ��Ӷԣ������������Σ�SO2�ļ۲���Ӷ�=2+
��6-1-3��1��=4����1���µ��Ӷԣ������������Σ�SO2�ļ۲���Ӷ�=2+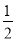 ��6-2��2��=3����1���µ��Ӷԣ�������V�Σ�
��6-2��2��=3����1���µ��Ӷԣ�������V�Σ�
��5�����ڱ�������õķǽ���Ԫ��F����������Ų�ʽΪ1s2 2s22p5����ԭ�ӵĹ����ʾʽΪ
���� | ���� | ���� | ���� | �� |
��6��������Ϊ���壬�۵�282�棬�е�315�棬�۷е�ͣ���300��������������������ˮ��Ҳ���������ѡ���ͪ���л��ܼ��������Ȼ���Ϊ���Ӿ��壻��7��������������Ϊx����x=��x+2+8����16�����x=2������������=������=12����Ԫ�ص�ΪMg����Ԫ��ԭ�ӵĵ����Ų�ʽ��1s22s22p63s2��[Ne]3s2��
���㣺����ԭ�ӽṹ��Ԫ�����ʡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������б�������У�߶�11��������ѧ�Ծ��������棩 ���ͣ�ѡ����
���й���ƽ�ⳣ��K��˵���У���ȷ����
A�����κ������£���ѧƽ�ⳣ����һ���㶨ֵ
B���ı䷴Ӧ��Ũ�Ȼ�������Ũ�ȶ���ı�ƽ�ⳣ��K
C��ƽ�ⳣ��Kֻ���¶��йأ��뷴ӦŨ�ȡ�ѹǿ��
D����ƽ�ⳣ��K�Ĵ�С�����ƶ�һ����Ӧ���еij̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������������ѧ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�������
(2��)��˹�����������Ϳ�ѧ�о����к���Ҫ�����塣��Щ��Ӧ�ķ�Ӧ����Ȼ��ֱ�Ӳ�ã�����ͨ����ӵķ����ⶨ���ָ�������3���Ȼ�ѧ��Ӧ����ʽ��
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ��H= �D24��8kJ��mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) ��H= �D47��4kJ��mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) ��H= +640��5kJ��mol
д��CO���廹ԭFeO����õ�Fe�����CO2������Ȼ�ѧ��Ӧ����ʽ��
_________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������������ѧ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Ӧ��A��g��+3B��g�� 2C��g�� ��H��0��ƽ�������������¶Ƚ��ͣ�������������ȷ����
2C��g�� ��H��0��ƽ�������������¶Ƚ��ͣ�������������ȷ����
A������Ӧ���ʼӴ��淴Ӧ���ʱ�С��ƽ��������Ӧ�����ƶ�
B������Ӧ���ʱ�С���淴Ӧ���ʼӴ�ƽ�����淴Ӧ�����ƶ�
C������Ӧ���ʺ��淴Ӧ���ʶ���С��ƽ��������Ӧ�����ƶ�
D������Ӧ���ʺ��淴Ӧ���ʶ���С��ƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������������ѧ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��a g��״̼��Ƹ��������ᷴӦ����Ӧ����ʧ��������ʱ��ı仯��������ͼ��ʵ����ʾ������ͬ�������£���b g��a��b����ĩ״̼�����ͬŨ�����ᷴӦ������Ӧ�����ߣ�ͼ��������ʾ����ȷ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ơ��dz��õ�ѧϰ����������ʱ�����������ۡ��������ƵĽ����У���ȷ����
A.��A��Ԫ���⻯��е�˳����GeH4 >SiH4 >CH4�����A��Ԫ���⻯��е�˳��Ҳ��AsH3 >PH3 >NH3
B.�ڶ�����Ԫ���⻯���ȶ���˳����HF >H2O >NH3�����������Ԫ���⻯���ȶ���˳��Ҳ��HCl >H2S >PH3
C.�������������ӣ����������ӣ��������������ӣ�Ҳ����������
D.�ɱ���CO2���Ƿ��Ӿ��壻��������裨SiO2��Ҳ�Ƿ��Ӿ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
[Co(NH3)5Cl]2+�����ӣ��������ӵ���λ����
A��1 B��2 C��4 D��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����Ļ�������������һ�и�һ�����л�ѧ�Ծ��������棩 ���ͣ������
��1��д�����л�ѧ��Ӧ�����ӷ���ʽ
������������Һ��������Һ��Ӧ
��̼��ƺ�����ϡ���ᷴӦ
��2�������������ӷ���ʽ����дһ�����������Ļ�ѧ����ʽ
��Zn��2H+==Zn2+��H2��
��HCO3-+ H+==CO2��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����Ļ�������������һ�и߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��ǿ���ǿ����ϡ��Һ�з�����Ӧʱ���к���Ϊ57.3 kJ �� mol��1��101 k Paʱ�����ȼ����Ϊ5518 kJ��mol-1���������Ȼ�ѧ����ʽ��д��ȷ����
A��H++OH��=H2O ��H = ��57.3kJ��mol��1
B��2NaOH(aq)+ H2SO4(aq)= Na2SO4(aq)+2H2O(l) ��H = ��114.6 kJ��mol��1
C��2C8H18(l) + 25O2(g) = 16CO2(g)+18H2O(g) ��H = ��11036 kJ��mol��1
D��2C8H18(l) + 25O2(g) = 16CO2(g)+18H2O(l) ��H = ��5518kJ��mol��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com