
分析 (1)容量瓶在使用前必须要查漏;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
B、先计算出浓硫酸的物质的量浓度为c=$\frac{1000ρω}{M}$,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;
(3)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
解答 解:(1)容量瓶带塞子,且在摇匀时要倒转过来摇晃,故容量瓶在使用前必须要查漏,故答案为:检查容量瓶是否漏水;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是BCAFED,故答案为:BCAFED;
B、浓盐酸的物质的量浓度为c=$\frac{1000ρω}{M}$=$\frac{1000×1.18×36.5%}{36.5}$=11.8mol/L,设配制250mLO.lmol/L的稀盐酸溶液所需的浓盐酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:11.8mol/L×VmL=250mL×O.lmol/L
解得V=2.1mL,故答案为:2.1mL.
(3)若没有对烧杯进行洗涤、将洗涤液注入容量瓶中,会导致溶质损失,则所配溶液的浓度偏低;若定容时俯视刻度线,则溶液体积偏小,浓度偏高,故答案为:偏低,偏高.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.2mol•L-1•min-1 | B. | 2mol•L-1•min-1 | ||
| C. | 5mol•L-1•min-1 | D. | 10mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 仪器A左上侧的分液漏斗中加入的是苯和溴水 | |
| B. | 仪器A的名称叫蒸馏烧瓶 | |
| C. | NaOH溶液的主要作用是除去反应后溶解在溴苯中的溴 | |
| D. | 碱石灰作用是防止空气中水蒸气进入反应体系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取浓盐酸时仰视读数 | |
| B. | 溶解搅拌时有液体飞溅 | |
| C. | 定容时仰视容量瓶瓶颈刻度线 | |
| D. | 摇匀后见液面下降,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
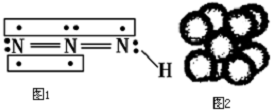
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只能含离子键,不能有共价键 | |
| B. | 所有非金属之间形成的化学键一定是共价键 | |
| C. | 电子数相同的两种微粒一定是同一元素 | |
| D. | 共价化合物中一定无离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Al3+、NO3-、SO42- | B. | Na+、CI-、Ca2+、NO3- | ||
| C. | OH-、NH4+、Na+、SO42- | D. | Fe3+、K+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成C的速率与C分解的速率相等 | |
| B. | A、B、C的浓度相等 | |
| C. | 单位时间生成n molA,同时生成3n molB | |
| D. | A、B、C的分子数之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
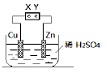
| A. | 直接连接X、Y,则该装置可将电能转变为化学能 | |
| B. | 直接连接X、Y,生成2.24LH2时一定转移0.2mole- | |
| C. | 将X、Y与直流电源相连,一段时间后,Zn片质量一定减少 | |
| D. | 将X、Y与直流电源相连,则该装置可能发生反应:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com