
| A. | 在c(HCO${\;}_{3}^{-}$)=0.1mol•L-1 的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 在由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Fe2+、ClO-、Na+、SO42- | |
| C. | pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SO42-、CO32-、Na+、K+ |
分析 A.碳酸氢根离子与铵根离子、铝离子发生双水解反应;
B.由水电离出的c(H+)=1×10-12mol•L-1的溶液中存在大量氢离子和氢氧根离子,次氯酸根离子能够氧化亚铁离子,次氯酸根离子能够与氢离子结合生成次氯酸,亚铁离子与氢氧根离子反应;
C.该溶液为酸性溶液,银氨离子与氢离子反应;
D.该溶液为碱性溶液,四种离子之间不发生反应,都不与氢氧根离子反应.
解答 解:A.NH4+、Al3+都与HCO3-发生水解反应,在溶液中不能大量共存,故A错误;
B.由水电离出的c(H+)=1×10-12mol•L-1的溶液为酸性或碱性溶液,Fe2+、ClO-之间发生氧化还原反应,ClO-与氢离子反应,Fe2+与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.pH=1的溶液中存在大量氢离子,[Ag(NH3)2]+与氢离子反应,在溶液中不能大量共存,故C错误;
D.使红色石蕊试纸变蓝的溶液为碱性溶液,SO42-、CO32-、Na+、K+离子之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 2A+3B=3C | B. | 3A+2B=2C | C. | 2A+2B=3C | D. | 2A+3B=2C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验过程 | 预期现象 | 实际观察到的现象 |
| a.取已切去表皮的一小块金属钠,放入盛有水的烧杯中 | 立即剧烈反应 | 开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应 |
| b.向盛有适量水(内含2滴酚酞)的试管中加入一小段镁条 | 有气泡产生,溶液变红色 | 没有相应现象,加热后仍无明显变化 |
| c.向两支盛有3mL 2mol•L-1硫酸的试管中加入大小相同的镁条和铝片 | 镁、铝与硫酸反应产生气泡剧烈程度不同 | 镁与硫酸反应产生气泡速率较快 |
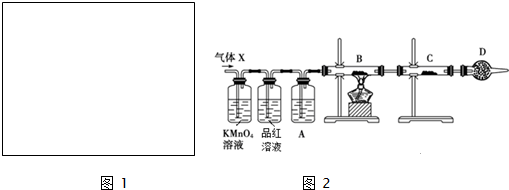
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将FeCl3溶液直接蒸干制取无水FeCl3固体 | |
| B. | 配制CuSO4溶液时,需加入少量的稀硫酸以抑制Cu2+水解 | |
| C. | 酸碱中和滴定实验中,用待测溶液润洗锥形瓶以减小实验误差 | |
| D. | 用广泛pH试纸测定溶液pH时,试纸需预先用蒸馏水湿润 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 蔗糖溶液中加入稀硫酸共热,冷却后加入银氨溶液,水浴加热,无银镜产生 | 蔗糖未发生水解 |
| B | 乙醇中加入浓硫酸共热,产生的气体通入溴水,溴水褪色 | 气体为纯净的乙烯 |
| C | 鸡蛋白溶液中分别加入饱和(NH4)2SO4溶液和HgCl2溶液均有白色沉淀 | 蛋白质均发生了盐析 |
| D | 微热含有酚酞的NaHCO3溶液,溶液红色加深 | 盐类水解反应为吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
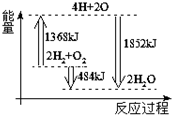
| A. | 由H、O原子形成2 mol H2O(g),共吸收1852 kJ能量 | |
| B. | 拆开2mol H2(g)和1 mol O2(g)中的化学键成为H、O原子,共放出1368 kJ能量 | |
| C. | 2mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量 | |
| D. | 2mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),共吸收484 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硝酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铝与氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| C. | 醋酸跟碳酸氢钠溶液反应:HCO3-+H+═CO2↑+H2O | |
| D. | 乙醇的催化氧化:2C2H5OH+O2→2CH3CHO+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com