
氧是地壳中含量最多的元素.
(1)氧元素基态原子核外未成对电子数为 个.
(2)H2O分子内的O﹣H键、分子间的范德华力和氢键从强到弱依次为 . 的沸点比
的沸点比 高,原因是 .
高,原因是 .
(3)H+可与H2O形成H3O+,H3O+原子采用 杂化.H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为 .
考点:
化学键和分子间作用力的区别;键能、键长、键角及其应用;原子轨道杂化方式及杂化类型判断;氢键的存在对物质性质的影响.
分析:
(1)s能级有一个轨道,最多排2个电子,p能级有3个轨道,每个轨道最多排2个电子,结合洪特规则分析;
(2)化学键的键能大于氢键的键能,氢键的键能大于分子间作用力;氢键对物质的物理性质产生影响,分子间氢键使物质的沸点升高,分子内氢键使物质的沸点降低;
(3)先确定VSEPR模型,然后在确定中心原子的杂化轨道类型;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力.
解答:
解:(1)氧元素基态原子核外电子排布式为1s22s22p4,4个电子在三个轨道中排布,故未成对电子数为2个,故答案为:2;
(2)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O﹣H键、分子间的范德华力和氢键从强到弱依次为O﹣H键、氢键、分子间的范德华力;含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键.
故答案为:O﹣H键、氢键、范德华力;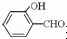 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大;
形成分子间氢键,分子间氢键使分子间作用力增大;
(3)H3O+价层电子对模型为四面体,氧原子采取sp3杂化.
H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大.
故答案为:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小.
点评:
本题把物质结构和性质与有机化合物的性质融合成一体,考查学生对元素推理、原子轨道杂化类型、分子空间结构、氢键、等电子体原理等知识的掌握和应用能力.本题基础性较强,难度较大.


 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:
下列说法错误的是()
A. 食物放在冰箱中会减慢食物变质的速率
B. 钾的金属性强,所以钾与水的反应比钠的反应剧烈
C. 2 mol SO2与1 mol O2混合后充分反应生成2 mol SO3
D. 面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下几个反应:
①Cl2+2KI=2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2FeCl3+2KI=2FeCl2+2KCl+I2
④I2+SO2+2H2O=H2SO4+2HI
判断氧化性由强到弱的顺序是()
A. Cl2>I2>Fe3+>SO2 B. Cl2>Fe3+>I2>SO2
C. Cl2>Fe3+>SO2>I2 D. Fe3+>I2>Cl2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
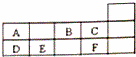
元素周期表是学习和研究化学的重要工具.表是元素周期表的一部分,A﹣F代表六种不同短周期元素.下列说法不正确的是( )
|
| A. | 原子序数E<C | B. | A、D同族 |
|
| C. | A、B同周期 | D. | C、F化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:
全球近140个国家将根据签署的《国际防治汞污染公约》,在2020年前禁止生产和出口含汞产品,如电池、荧光灯、化妆品、温度计、血压计等,分析如图判断关于汞元素的相关信息正确的是( )

|
| A. | 汞的化学式为Hg | B. | 汞原子的质量为200.6g |
|
| C. | 汞原子的中子数是80 | D. | 汞为非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B. 升高温度或加入催化剂,可以改变化学反应的反应热
C. 据能量守恒定律,反应物的总能量一定等于生成物的总能量
D. 物质发生化学变化一定伴随着能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A的分子式为C9H10O2,A在光照条件下生成一溴代物B,B~K十种有机物之间发生的转化关系如下:
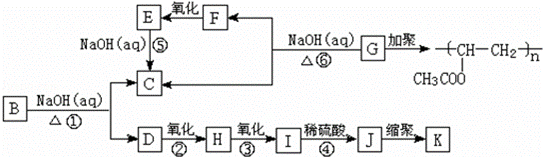
其中J物质与氯化铁溶液能发生显色反应,且环上的一元取代物只有两种结构.
已知:①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH→RCH2CHO;
②﹣ONa连在烃基上不会被氧化.
请回答下列问题:
(1)写出下列反应的化学方程式:
J生成K
反应①
J与足量碳酸钠溶液反应: .
(2)同时符合下列要求的A的同分异构体有14种.
Ⅰ.含有苯环
Ⅱ.能发生银镜反应和水解反应
其中核磁共振氢谱有5个吸收峰且1mol该同分异构体能与1molNaOH反应,其结构简式为: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com