
| A、NH4Cl |
| B、CaCl2 |
| C、HCl |
| D、NaOH |


科目:高中化学 来源: 题型:
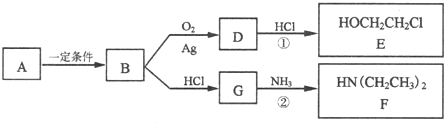
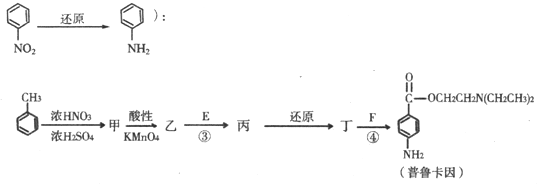
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| B、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| C、用铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面出现一层铜 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
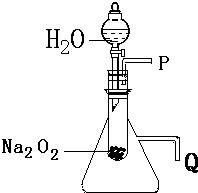 用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.4gCu与足量硫完全反应,转移的电子数为0.1NA |
| B、能使湿润的KI淀粉试纸变蓝的气体一定是Cl2 |
| C、分离Na2CO3溶液和CH3COOC2H5常用蒸馏法 |
| D、将H2S通入FeCl3溶液中会产生淡黄色沉淀,继续通入则会产生黑色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 锥形瓶编号 | 30% H2O2/mL | 0.1mol?L-1Fe2(SO4)3/mL | 蒸馏水/mL | 反应温度/℃ |
| 1 | 10 | 1 | 0 | 30 |
| 2 | Vx | 1 | 5 | 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
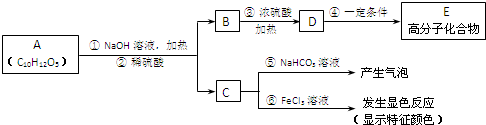
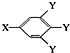 (其中:-X、-Y均为官能团).据此回答下列问题:
(其中:-X、-Y均为官能团).据此回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com