
| A.用托盘天平称量25.20g氯化钠固体 |
| B.用250ml容量瓶配制150mL一定浓度的盐酸溶液 |
| C.用一束强光照射经过煮沸的三氯化铁溶液有光亮的通路,说明已生成氢氧化铁胶体 |
| D.过量的铁丝在氯气中点燃,可制取氯化亚铁 |
科目:高中化学 来源:不详 题型:实验题
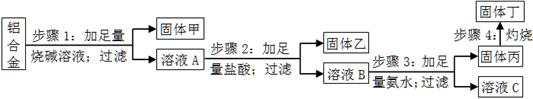
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
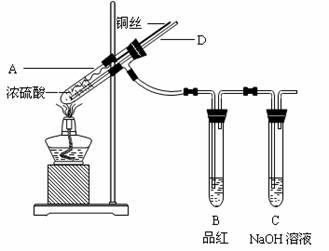
| A.固体甲中,CuS和Cu2S不能同时存在 |
| B.固体甲中,CuO和Cu2O至少有一种 |
| C.固体甲中若没有Cu2O,则一定有Cu2S |
| D.固体甲中若存在Cu2O,也可能有Cu2S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
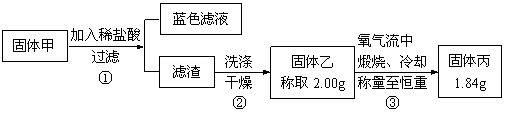
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
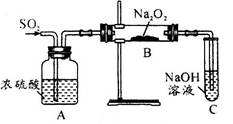
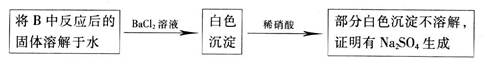
 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O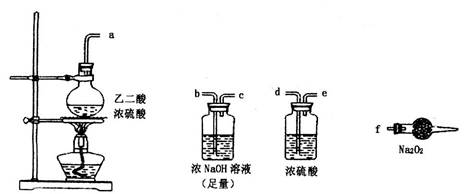
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

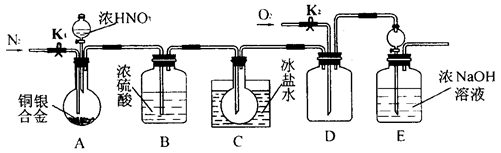
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
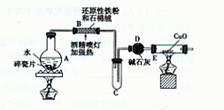
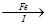 FeSO4溶液
FeSO4溶液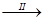 FeSO4·7H2O晶体
FeSO4·7H2O晶体
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 沉淀质量,以确定碳酸钙的质量分数。
沉淀质量,以确定碳酸钙的质量分数。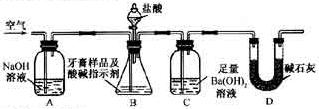
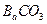 质量,只要测定装置C在吸收
质量,只要测定装置C在吸收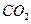 前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______.
前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com