
(共10分)以下框图中A~M是中学化学常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。 
(1)B的化学式______;
(2)19.5gC与足量的水反应转移电子的物质的量为______mol;
(3)写出物质C的电子式 ;
(4)写出②、③反应的离子方程式② ,③ 。
(各2分,共10分)
(1)Al2O3;
(2)0.25mol;
(3) 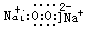
(4)②4Fe(OH)2+O2+2H2O = 4Fe(OH)3,
③2Al+Fe2O3  Al2O3 + 2Fe。(条件不扣分,离子写错0分)
Al2O3 + 2Fe。(条件不扣分,离子写错0分)
解析试题分析:由题意可知,C是Na2O2,则F 是氧气,G是NaOH;D为红棕色粉末,M为红褐色固体,则D
是Fe2O3,M是Fe(OH)3,Fe2O3与Al在高温下发生铝热反应生成Fe和Al2O3,所以A 是Fe,B是Al2O3,E是Al,Al与NaOH溶液反应生成偏铝酸钠和氢气,所以J是氢气,I是偏铝酸钠;D是Fe2O3,H是氯化铁,与铁反应生成氯化亚铁,所以F是Fe(OH)2。
B的化学式为Al2O3,
19.5g Na2O2的物质的量是0.25mol,与水的反应中有一半作了氧化剂,一半作了还原剂,所以0.25mol过氧化钠与水反应转移电子的物质的量是0.25mol×1/2×2=0.25mol;
过氧化钠是离子化合物,其电子式为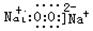 ;
;
反应②是氢氧化亚铁与氧气转化为氢氧化铁的反应,化学方程式为4Fe(OH)2+O2+2H2O = 4Fe(OH)3,反应③是铝热反应,化学方程式为2Al+Fe2O3  Al2O3 + 2Fe。
Al2O3 + 2Fe。
考点:考查物质的推断,氧化还原反应的计算,化学式、化学方程式、电子式的书写


科目:高中化学 来源: 题型:单选题
下列各组物质中,物质之间通过一步反应就能实现图示变化的是
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① |  | FeCl2 | FeC13 | Fe | CuCl2 |
| ② | Mg | MgO | MgCl2 | Mg(OH)2 | |
| ③ | NaOH | Na2CO3 | NaHCO3 | NaCl | |
| ④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略去),下列说法不正确的是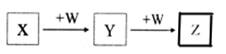
| A.若W是单质铁,则Z溶液可能是FeCl2溶液 |
| B.若W是氢氧化钠,则X与Z可反应生成Y |
| C.若X是碳酸钠,则W可能是盐酸 |
| D.若W为氧气,则Z与水作用(或溶于水)一定生成一种强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
沉淀固体B ;C ;
沉淀D ;溶液E 。
(3)写出①、②、③、④四个反应方程式(是离子反应的写出离子方程式)
① ;② ;
③ ; ④ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
中学化学中的一些常见物质有下图转化关系(部分产物未给出)。其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属。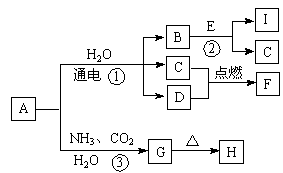
回答下列问题。
(1)F的电子式为 。
(2)G的化学式为 。
(3)写出反应①的化学方程式 。
(4)写出反应②的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、Y为常见金属单质,X为常见非金属单质。常温下X、G、H、I为气体,C为液体。B是由三种元素组成的盐,加热时发生分解生成两种气体,冷却后又可化合得到B。有关物质之间的转化关系如下图(部分反应条件及生成物略去)。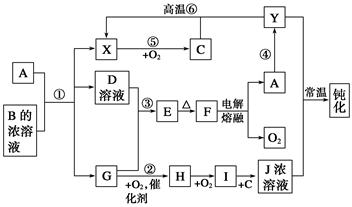
请填写下列空白:
(1)B的电子式为____________________________;
(2)现用A与石墨作电极,B的浓溶液作电解质溶液,构成原电池。其正极反应式为____________________;
(3)反应⑥的化学方程式为__________________________,反应④在冶金工业上属于________________(填金属的冶炼方法);
(4)从D的结晶水合物制备D的无水晶体的操作为_____________________________;
(5)反应②的化学方程式为________________________________________________;
反应③的离子方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。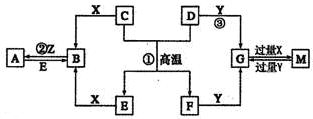
(1)写出X的电子式: 。
(2)常温时pH =12的G溶液中,溶质的阳离子与溶质的阴离子浓度之差为 (写出计算式)。
(3)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则铜是____极,请写出在E电极上发生的电极反应式: 。
(4)写出反应③的离子方程式: 。
(5)现有无标签的Y和M的两种无色水溶液,不用其他任何试剂,请你设计一个简单的实验对这两种溶液加以鉴别 (回答实验操作、现象及结论)。
(6)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp =2.097×l0-39。将0.01 mol/L的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀____(填“能”或“不能”),请通过计算说明 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图中A~G是化合物,H是一种无色气态单质,D高温下是气体,而常温下是一种无色液体, E为淡黄色的固体。它们之间有如下转化关系: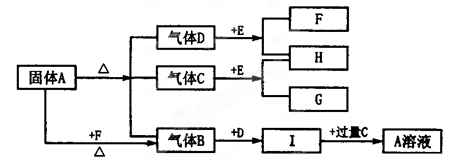
(1)写出A的化学式 ;C的结构式 ;
(2)A溶液与过量F溶液反应的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )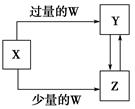
| 选项 | W | X |
| A | 盐酸 | Na2CO3溶液 |
| B | 稀HNO3 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | O2 | Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com