
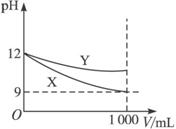
A.X是弱碱,Y是强碱
B.X、Y两种溶液稀释前溶质的物质的量浓度相等
C.两种溶液稀释后恢复至原温度,溶液中c(H+)与c(OH-)之比都变大
D.两种溶液稀释后恢复至原温度,溶液中c(H+)与c(OH-)的乘积都变小
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
 .核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有
.核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| △ |
| ||
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
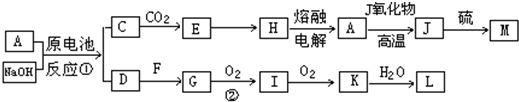
(12分) A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。
请回答以下问题:
(1)写出原电池的负极反应方程式______________________________________。
(2)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为____________(写出计算式);相同条件下,等浓度的C溶液与CH3COONa溶液中,C的阴离子与CH3COO-浓度的大小关系:前者_______后者(用“>”、“<”或“=”表示)。
(3)写出②的化学方程式____________________________________________________。
(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色。
①X的水溶液与NaHCO3溶液混合,反应的离子方程式为 。
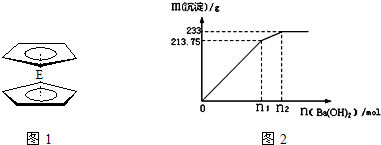
②500mLX的溶液与Ba(OH)2反应生成沉淀的质量与加入Ba(OH)2物质的量的关系如图:
请回答:X晶体的俗名为__________;其溶液的物质的量浓度为_________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com