
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 10mL0.01mol•L-1的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 | |
| C. | 向醋酸溶液中加少量的CH3COONa固体,平衡逆向移动 | |
| D. | 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
分析 A.醋酸是弱电解质,其电离程度较小,任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.加水稀释醋酸促进醋酸电离,但溶液中氢离子浓度减小,再结合水的离子积常数确定溶液中氢氧根离子浓度变化;
C.向醋酸溶液中加入含有醋酸根离子或氢离子的物质都抑制醋酸电离;
D.醋酸是弱电解质,氢氧化钠是强电解质,常温下,pH=2的醋酸溶液浓度大于pH=12的氢氧化钠溶液,二者等体积混合,醋酸过量.
解答 解:A.醋酸是弱电解质,其电离程度较小,任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.加水稀释醋酸促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,导致溶液中氢离子浓度减小,温度不变,水的离子积常数不变,则溶液中氢氧根离子浓度增大,故B错误;
C.向醋酸溶液中加入含有醋酸根离子或氢离子的物质都抑制醋酸电离,所以向醋酸溶液中加入醋酸钠固体,醋酸根离子浓度增大则抑制醋酸电离,平衡向逆反应方向移动,故C正确;
D.醋酸是弱电解质,氢氧化钠是强电解质,常温下,pH=2的醋酸溶液浓度大于pH=12的氢氧化钠溶液,二者等体积混合,醋酸过量导致混合溶液呈酸性,pH<7,故D正确;
故选B.
点评 本题考查了弱电解质的电离,根据弱电解质电离的影响因素、电荷守恒、酸碱混合溶液定性判断等知识点来分析解答即可,易错选项是C,注意:加水稀释醋酸能促进醋酸电离,但溶液中醋酸分子、醋酸根离子、氢离子浓度都减小,只有氢氧根离子浓度增大,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:实验题
(NH4)2Fe( SO4)2·6H2O(硫酸亚铁铵的结晶水合物)是重要的化工原料和化学试剂,在空气中长期放置会被氧化而变质。某课题小组为了探究莫尔盐的分解产物,开展了如下实验:
SO4)2·6H2O(硫酸亚铁铵的结晶水合物)是重要的化工原料和化学试剂,在空气中长期放置会被氧化而变质。某课题小组为了探究莫尔盐的分解产物,开展了如下实验:
已知:五氧化二磷是酸性干燥剂,假设干燥管中试剂均足量。
(1)甲同学设计如下实验检验(NH4)2Fe(SO4)2·6H2O分解的部分产物。装置A的气密性的检查方法是 。
①B装置的作用是 。
②M干燥管中所放的药品是 。
(2)检验(NH4)2Fe(SO4)2·6H2O是否变质的试剂是 (填化学式);检验是否完全变质的实验方法是 。
(3)实验室常用(NH4)2Fe(SO4)2·6H2O标准溶液测定过二硫酸铵[(NH4)2S2O8]的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:S2O82-+2Fe2+  2Fe3++2SO42-)。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
2Fe3++2SO42-)。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
实验序号 | 起始读数/mL | 终点读数/mL |
Ⅰ | 2.50 | 22.58 |
Ⅱ | 1.00 | 23.12 |
Ⅲ | 0.00 | 19.92 |
①完成上述实验需要准确量取20.00 mL过二硫酸铵溶液,所用仪器的名称是 。
②根据上述数据计算,样品的纯度为  (用含w、c的代数式表示)。
(用含w、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省绵阳市高一上第一次月考化学试卷(解析版) 题型:选择题
实验时,不慎把浓硫酸洒在皮肤上,正确的处理方法是( )
A. 用水冲洗,再涂上硼酸溶液
B. 用氢氧化钠溶液中和,再用水冲洗
C. 用布擦去硫酸后,用稀氢氧化钠溶液冲洗
D. 用大量清水冲洗,再用3%~5%的碳酸氢钠溶液冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
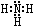 ;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为
;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为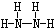 .若64g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500kJ/mol.
.若64g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
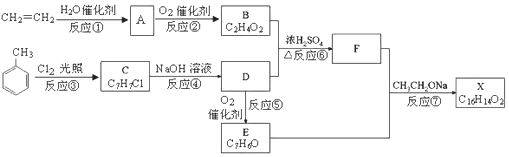
 .
.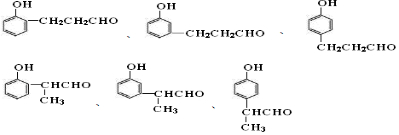 中的任意一种.
中的任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )
常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )| A. | HR为强电解质 | |
| B. | 图中四点,水的电离程度:c>b>d>a | |
| C. | 若常温时,0.1mol/LHR溶液的电离度为1%,则常温时R+的水解常数约为10-9 | |
| D. | b点溶液中存在c(Na+)=c(R+)+c(HR) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
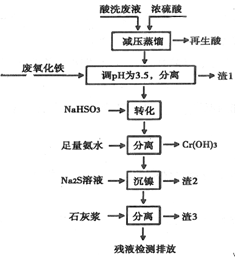
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com