
【题目】有等体积、等pH的Ba(OH)2、NaOH和NH3H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3 , 则三者的大小关系正确的是( )
A.V3>V2>V1
B.V3=V2=V1
C.V1=V2>V3
D.V3>V2=V1
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】有①![]() 、
、![]() 、
、![]() ②H2、D2、T2 ③石墨、金刚石④科学家们发现氢元素有三种同位素原子四组微粒或物质,回答下列问题:
②H2、D2、T2 ③石墨、金刚石④科学家们发现氢元素有三种同位素原子四组微粒或物质,回答下列问题:
(1)分别写出氢元素三种同位素的名称:______、_______、______。写出用做制造氢弹原料的同位素原子:______(填原子符号)。
(2)互为同位素的是________(填编号,下同)。
(3)互为同素异形体的是_______。
(4)由①和④中微粒能结合成三原子化合物,写出这些化合物的相对分子质量的最大值和最小值是_____________。
(5)质量相同的H216O 和D216O 所含质子数之比为_______,中子数之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是( ) 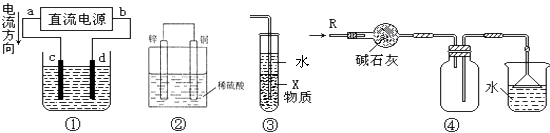
A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O42NO2 , 隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40s内用N2O4表示的平均反应速率为molL﹣1s﹣1 .
(2)计算在80℃时该反应的平衡常数K= .
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有(填字母).
a.增大N2O4起始浓度
b.向混合气体中通入NO2
c.使用高效催化剂
d.升高温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组因发生氧化还原反应而不能大量共存的是
A.Ag+、SO42-、HCO3-、Cl-B.Mg2+、Cl-、Na+、OH-
C.K+、MnO4-、H+、Fe2+D.Ba2+、Cl-、NH4+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(![]() )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产
)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产![]() 的主要流程如下:
的主要流程如下:
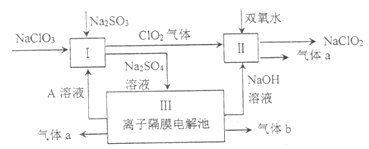
(1)I中发生反应的还原剂是________(填化学式)。
(2)II中反应的离子方程式是_________。
(3)III中离子隔膜电解池的装置如下:
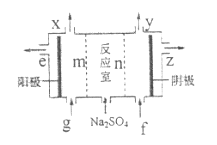
①A的化学式是_________,A在_________口产生。
②m为_______(填“阴”、“阳”)离子交换膜。
③结合化学用语和文字说明解释![]() 产生的原因:_________。
产生的原因:_________。
(4)![]() 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备: ![]()
①该反应中氧化剂和还原剂的物质的量之比是_________。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中![]() 的含量越大,运用氧化还原反应规律分析其原因是___________。
的含量越大,运用氧化还原反应规律分析其原因是___________。
(5)![]() 变质可分解为
变质可分解为![]() 和
和![]() 。取等质量变质前后的
。取等质量变质前后的![]() 试样均配成溶液,分别与足量
试样均配成溶液,分别与足量![]() 溶液反应时,消耗
溶液反应时,消耗![]() 的物质的量前者_______(填>、<、=)后者。
的物质的量前者_______(填>、<、=)后者。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如下图所示:

下列说法正确的是( )
A. 气体A是SO2和CO2的混合气体
B. 固体A一定含有SiO2,可能含有BaSO4
C. 该固体混合物中Fe2O3和Fe至少有其中一种
D. 该固体混合物一定含有Fe、Na2SO3、BaCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com