
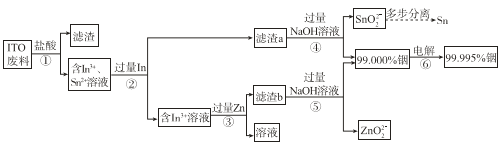
����Ŀ���ӷϾ�Һ����ʾ�������� ITO����Ҫ�ɷ��Ǻ������������������������������ʾ��ͼ���¡�
���ϣ�
���� | ����In�� | ����Sn�� |
���ڱ�λ�� | �������ڡ���IIIA�� | �������ڡ���IVA�� |
��ɫ��״̬ | ����ɫ���� | ����ɫ���� |
���������� | ������Ӧ | ������Ӧ |
��ǿ����Һ | ����Ӧ | ��Ӧ |
��1��Ϊ�˼ӿ첽��ٵķ�Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ��______�����ٴ����㣩��
��2�������������������ת����In3+�����ӷ���ʽ��______��
��3��������м���������ܹ���ȥ��Һ�е�Sn2+�������������Ϸ�����ԭ����______��
��4������ܺ͢���NaOH��Һ��������______��
��5����ͼ��ģ�⾫������װ��ͼ�����ڷ�������д��Ӧ�����ʡ�_____
���𰸡� ��������Ũ�ȡ����ȡ������Ϸ��� In2O3+6H+==2In3++3H2O ͬ��������Ԫ�ش�������ԭ�Ӱ뾶��С�������Լ�������ԭ�Լ����� ��ȥa��b���������е�����п 
����������1���ӿ췴Ӧ���ʣ��ɲ�������Ӧ��Ũ�ȣ����»����������Һ��ĽӴ�����ȷ������ʴ�Ϊ����������Ũ�ȡ����ȡ������Ϸ�����
��2��������м����ᣬ���������������ܽ�����In3+��Sn2+����������������InΪ+3�ۣ���������Ļ�ѧʽΪIn2O3��������ת����In3+�����ӷ���ʽ��In2O3+6H+=2In3++3H2O��
��3�����ݱ������Ͽ�֪��In��SnΪͬ����Ԫ�ء�ͬ��������Ԫ�ش�������ԭ�Ӱ뾶��С�������Լ�������ԭ�Լ���������In������ǿ��Sn������Һ�м��������In��In�ܹ���Sn2+��Ӧ����Sn��
��4�����̷��������������������Ὣ���������������ܽ⣬�õ���In3+��Sn2+����Һ������ڣ����������In��In��Sn2+��Ӧ�û���Sn������In3+�����ˣ�����a����Ҫ�ɷ�ΪSn��δ��Ӧ���In����ҺΪIn3+��Һ������ۣ�����Һ�м��������Zn��Zn��In3+��Ӧ�û���In��������������b����Ҫ�ɷ�ΪIn��δ��Ӧ���Zn������ݣ�������b�м��������NaOH��Һ��In��NaOH����Ӧ��Zn��NaOH��Ӧ����������ˮ��ZnO22-��ʵ��Zn��In���롣����ܣ�������a�м������NaOH��Һ��Sn��NaOH��Ӧ����In����Ӧ����ﵽʹSn��In�����Ŀ�ġ�������������������ܺ͢ݼ���NaOH��Һ��Ŀ��Ϊ��ȥa��b���������е�����п��
��5������In���������뾫��Cu��װ�á�����In(99.000��)����������In���������������ҺΪ��In3+����Һ��װ��ͼ�ɱ�ʾΪ�� ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ��������ȷ����
A. ��֪2H2(g)+O2(g)=2H2O(g) ��H=-483.6kJ/mol����������ȼ����Ϊ241.8 kJ/mol
B. ��֪C(ʯī��s)=C(���ʯ��s) ��H>0������ʯ��ʯī�ȶ�
C. ��֪2C(s)+2O2(g)=2CO2(g) ��H1; 2C(s)+O2(g)=2CO(g) ��H2;������H1����H2
D. ��20.0gNaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ����������÷�Ӧ�к��ȵ��ȷ���ʽΪNaOH(aq)+ HCl(aq)=NaCl(aq)+H2O(l) ��H��һ57.4kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.����ռ�����ڼ�B.SiO2��SO2����������������
C.���ܵ����H���Ļ������������D.��������һ�����н�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����20mL 0.1 mol/L��CH3COOH��Һ����εμ�0.1 mol/L��NaOH��Һ������NaOH��Һ���������ҺpH�ı仯��ͼ��ʾ������˵����ȷ����
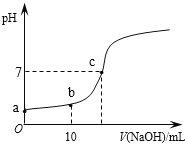
A. a���pH=1
B. b��ʱ��c (CH3COO��)=0.05mol/L
C. c��ʱ��V(NaOH)=20mL
D. ��Ӧ������![]() ��ֵ��������
��ֵ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ���о�pH��һ��Ũ��FeSO4���ȶ��Ե�Ӱ�죬������ͼ��������������

A. pHС��1ʱ��������������ģ����ܵ�ԭ����4Fe2++ O2+ 10H2O![]() 4Fe(OH)3 + 8H+ƽ�������ƶ�
4Fe(OH)3 + 8H+ƽ�������ƶ�
B. pH��3.0~5.5֮�䣬pH�ı仯��FeSO4�ȶ���Ӱ�첻��
C. pH����6.5ʱ�����������ͻ�䣬���ܵ�ԭ�������ɵ�Fe(OH) 2���ױ�����
D. ����������ͬʱ��FeSO4��Һ�м�������(NH4)2SO4���壬FeSO4���ȶ��Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ᴿ�������ʣ�������Ϊ���ʣ���ʹ�õ��Լ��ͷ��뷽������ȷ���ǣ� ��
���� | �Լ� | ���뷽�� | |
�� | ����أ��Ȼ��ƣ� | ����ˮ | ���½ᾧ |
�� | ������̼���Ȼ��⣩ | ����̼������Һ | ϴ�� |
�� | �Ҵ���ˮ�� | ��ʯ�� | ���� |
�� | �Ȼ�泥��Ȼ����� | ����������Һ | ���� |
A.�٢�B.�٢�C.ֻ�Т�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���о�Na2S��Һ��KMnO4��Һ��Ӧ��̽���������¡�
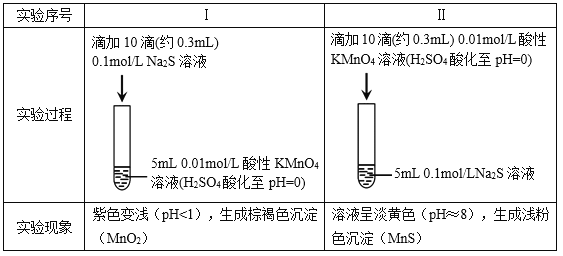
���ϣ���. ![]() ��ǿ���������±���ԭΪMn2+���ڽ����������±���ԭΪMnO2��
��ǿ���������±���ԭΪMn2+���ڽ����������±���ԭΪMnO2��
��. �����������������Һ����Һ�ʵ���ɫ��
��1������ʵ���֪��Na2S����________�ԡ�
��2����ͬѧԤ��ʵ��I��S2�C��������![]() ��
��
�ٸ���ʵ��������ͬѧ��Ϊ��Ԥ�ⲻ������������________��
����ͬѧȡʵ��I��������Һ����ʵ�飬����![]() ���ó�S2�C��������
���ó�S2�C��������![]() �Ľ��ۣ���ͬѧ���˸ý��ۣ�������________��
�Ľ��ۣ���ͬѧ���˸ý��ۣ�������________��
��ͬѧ�Ǿ����ۺ����������ʵ�飬֤ʵ��������![]() ��ȷ���Խ�S2�C������
��ȷ���Խ�S2�C������![]() ��
��
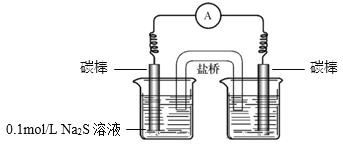
a.�Ҳ��ձ��е���Һ��________��
b.��ͨ�������ָ��ƫת��һ��ʱ���________�������������
��3��ʵ��I������������i���ڲ��죬��ԭ���������ɵIJ��Mn2+��������ķ�Ӧ�![]() ��������Ӧ���÷�Ӧ�����ӷ���ʽ��________��
��������Ӧ���÷�Ӧ�����ӷ���ʽ��________��
��4��ʵ��II������������Ҳ����ȫ�������ͬѧ������ԭ���루3�����ƣ�����֤�������������ʵ�鷽����______��
��5����˼��ʵ�飬��Ӧ����ͬ��������ͬ�����������ʱ仯�������������������йأ�����________�����йء�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ����ķ�����ᴿ�������õķ����У����ˡ�������������ȡ�����������ȷֽ�ȣ����и�������ķ�����ᴿӦ����ʲô������
��1��ʵ�����е�ʯ��ˮ���ã�Һ���ϳ�������CaCO3���������ķ�����ȥCa��OH��2��Һ��������CaCO3������
��2��ʵ��������ȡ��Fe��OH��3�����г�����������Cl�� �� �����ķ�����ȥFe��OH��3�����л��е�����Cl�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��һ����Ҫ��ʯ�ͻ���ԭ�ϣ����������Ʊ�ϩ���������ľ��ü�ֵ��������壬����һ�ֹ���ԭ������:
��C3H8(g)![]() C3H6(g)+H2(g)��H1
C3H6(g)+H2(g)��H1
��C3H8(g)![]() C2H4(g)+CH4(g) ��H2=+81.7kJ/mol
C2H4(g)+CH4(g) ��H2=+81.7kJ/mol
��C2H4(g)+H2(g)![]() C2H6(g) ��H3
C2H6(g) ��H3
��C3H8(g) +H2(g)![]() CH4(g)+C2H6(g) ��H4=-54.8kJ/mol
CH4(g)+C2H6(g) ��H4=-54.8kJ/mol
(1)���㷴Ӧ�۵ķ�Ӧ�ȡ�H3=______________��
(2)��������ƽ�ⳣ���������ѽ����ѡ�������¶ȹ�ϵ��ͼ1��ʾ����ͼ���жϡ�H2____0����ҵ�����в��õ��¶�600-650�棬ԭ����__________________��
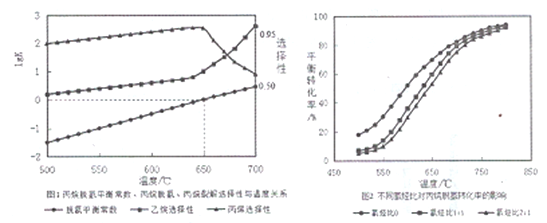
(3)�¶�Ϊ650��ʱ����1L��������Ͷ��1molC3H8��1molH2������Ӧ���������������C3H8����������Ϊ(����3λ��Ч���֣���ͬ)_________________(��֪: ![]() )
)
(4)��ͬ�����Ⱥ��¶ȶԱ�Ժ����ƽ��ת���ʵ�Ӱ������ͼ2��ʾ����ͬ�¶��£�����������ƽ��ת�����½���ԭ����__________________��
(5)��ϩ���������������Ƶñ�ϩ��(��HR��ʾ������볣��Ka=5.55��10-5)�������£���ϩ���Ƶ�ˮ�ⳣ��Ϊ________����0.2mol/LHR��0.1mol/LNaOH�������ϣ�����Һ�е�����Ũ�ȴ�С˳��Ϊ__________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com