
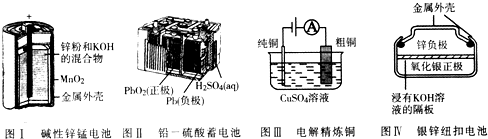
| A. | 图I所示电池中,锌极电极反应为Zn-2e-═Zn2+ | |
| B. | 图Ⅱ所示电池放电过程中,每转移1mo1电子,生成1mol PbSO4 | |
| C. | 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 | |
| D. | 图Ⅳ所示电池中,Ag2O在电池工作过程中被氧化为Ag |
分析 A.碱性条件下锌被氧化生成氢氧化锌;
B.根据放电过程中电池反应判断;
C.粗铜中不仅含有铜还含有其它金属,根据转移电子守恒判断溶液中铜离子浓度是否变化;
D.在氧化还原反应中,得电子化合价降低的是氧化剂.
解答 解:A.所示电池中,电解质为KOH,负极电极反应为Zn-2e-+2OH-═Zn(OH)2,故A错误;
B.铅蓄电池放电反应的方程式为Pb+PbO2+2H2SO4=2PbSO4+2H2O~2e-,则每转移1mo1电子,生成1mol PbSO4,故B正确;
C.电解精炼铜,阳极放电的是铜及比铜活泼的金属,阴极只有铜离子生成铜单质,电解质溶液中Cu2+浓度变小,故C错误;
D.Ag2O是正极,正极发生还原反应,电池工作过程中被还原为Ag,故D错误.
故选B.
点评 本题考查原电池和电解池原理,为高频考点,侧重于学生的分析能力的考查,明确电极上发生的反应是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 某温度下水的离子积常数为Kw,在该温度下,a mol•L-1一元酸HA与b mol•L-1一元碱BOH等体积混合,溶液呈中性,则溶液中c(H+)=$\sqrt{Kw}$ | |
| B. | 已知MgCO3的Ksp=6.82×10-6mol2•L-2,则在含有固体MgCO3的Na2CO3溶液中,有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| C. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度 | |
| D. | NH4Cl和NH3•H2O的混合溶液中,分别存在NH4+的水解平衡和NH3•H2O的电离平衡,二者对对方的平衡都起了促进作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度 | |
| B. | 加入CaCl2促进了HCO3-的电离 | |
| C. | 反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3 | |
| D. | 反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用潮汐发电是将化学能转化为电能 | |
| B. | 蒸馏法淡化海水的过程中一定发生了化学变化 | |
| C. | 从海水中可以获得MgCl2,电解熔融MgCl2可制备Mg | |
| D. | 可以用分液的方法将海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol铁与1molCl2充分反应,转移电子数为3NA | |
| B. | 常温常压下,2gD216O 中含中子数、质子数、电子数均不相等 | |
| C. | 14g 分子式为CnH2n 的(n≥2)链烃中含有的C=C 的数目一定为$\frac{{N}_{A}}{n}$ | |
| D. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯可用作制食品包装袋的原料 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| D. | 含硫燃料燃烧产生的二氧化硫是形成酸雨的罪魁祸首 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
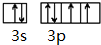 ,该元素的符号是S.
,该元素的符号是S.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
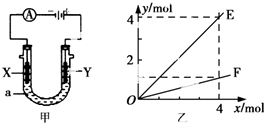
| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgN03溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极.a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 molL-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
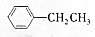 +Br2(g)$\stackrel{光照}{→}$
+Br2(g)$\stackrel{光照}{→}$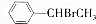 +HBr(一溴取代反应只发生在侧链的α碳原子上).
+HBr(一溴取代反应只发生在侧链的α碳原子上).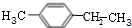 ,B1
,B1 ,B2
,B2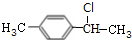 ,C1
,C1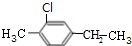 ,C2
,C2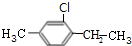 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com